题目内容
用NA表示阿伏伽德罗常数的值.下列叙述正确的是( )
| A、1mol硝基(-NO2)与NA个二氧化氮气体分子所含电子数相等 |
| B、1mol氢氧根离子(OH-)与NA个羟基(-OH)所含电子数相等 |
| C、在相同温度下,pH=1且体积为1L的硫酸溶液所含氢离子数与pH=13且体积为1L的氢氧化钠溶液所含氢氧根离子数一定均为0.1NA |
| D、在反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,每生成1molO2该反应共转移的电子数为6NA |
考点:阿伏加德罗常数,氧化还原反应的电子转移数目计算
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.硝基和二氧化氮中都含有23个电子,1mol中含有23mol电子;
B.氢氧根离子中含有10个电子,羟基中含有9个电子;
C.温度影响水的离子积,不是常温下,pH=13的氢氧化钠溶液中氢氧根离子浓度不是0.1mol/L;
D.根据化合价变化判断生成1mol氧气转移的电子数.
B.氢氧根离子中含有10个电子,羟基中含有9个电子;
C.温度影响水的离子积,不是常温下,pH=13的氢氧化钠溶液中氢氧根离子浓度不是0.1mol/L;
D.根据化合价变化判断生成1mol氧气转移的电子数.
解答:
解:A.1mol硝基(-NO2)中含有23mol电子,NA个二氧化氮气体的物质的量为1mol,含有23mol电子,二者所含电子数相等,故A正确;
B.1mol氢氧根离子(OH-)含有10mol电子,NA个羟基(-OH)的物质的量为1mol,含有9mol电子,所含电子数不相等,故B错误;
C.在相同温度下,pH=1且体积为1L的硫酸溶液,氢离子浓度为0.1mol/L,含有0.1mol氢离子;由于温度不同,水的离子积不同,没有告诉在常温下,pH=13的氢氧化钠溶液中氢氧根离子浓度不一定为0.1mol/L,含有的氢氧根离子不一定为0.1mol,故C错误;
D.反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,亚铁离子和过氧化钠中-1价O的化合价升高,过氧化钠中O元素化合价降低,Na2FeO4中Fe元素的化合价为+6价,化合价升高了:[(+6-(+2)]×2+[0-(-1)]×2=10,即生成1mol氧气转移了10mol电子,转移的电子数为10NA,故D错误;
故选A.
B.1mol氢氧根离子(OH-)含有10mol电子,NA个羟基(-OH)的物质的量为1mol,含有9mol电子,所含电子数不相等,故B错误;
C.在相同温度下,pH=1且体积为1L的硫酸溶液,氢离子浓度为0.1mol/L,含有0.1mol氢离子;由于温度不同,水的离子积不同,没有告诉在常温下,pH=13的氢氧化钠溶液中氢氧根离子浓度不一定为0.1mol/L,含有的氢氧根离子不一定为0.1mol,故C错误;
D.反应2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑中,亚铁离子和过氧化钠中-1价O的化合价升高,过氧化钠中O元素化合价降低,Na2FeO4中Fe元素的化合价为+6价,化合价升高了:[(+6-(+2)]×2+[0-(-1)]×2=10,即生成1mol氧气转移了10mol电子,转移的电子数为10NA,故D错误;
故选A.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项C、D为易错点,注意温度对水的离子积的影响、能够根据化合价判断计算注意的电子数.

练习册系列答案
相关题目
下列有机物命名正确的是( )
A、1,3,4-三甲苯 |
B、α-氨基苯丙酸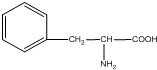 |
| C、2-甲基丙烯 (CH3)2C=CH2 |
| D、2,2-二甲基-3-丁醇 (CH3)3C-CHOH-CH3 |
在pH=3的FeCl3溶液和pH=3的盐酸中,由水电离出来的H+的浓度分别为C1、C2,pH=11的Na2CO3溶液中水电离出来的OH-的浓度为C3,则它们之间的关系是( )
| A、C1<C2<C3 |
| B、C1=C3>C2 |
| C、C1>C2>C3 |
| D、无法判断 |
下列说法正确的是( )
| A、pH=2和pH=1的硝酸中c(H+)之比为10:1 | ||
| B、一元酸与一元碱恰好完全反应后的溶液中一定存在c(H+)=c(OH-) | ||
C、KAl(SO4)2溶液中离子浓度的大小顺序为c(SO
| ||
| D、常温下,将pH均为12的氨水和NaOH溶液分别加水稀释100倍后,NaOH溶液的pH较大 |
常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A、①与②中c(H+)相同 |
| B、①与④混合,溶液中c(CH3COO-)=c(Na+) |
| C、②和③混合,所得混合溶液的pH等于7 |
| D、③与④分别用等浓度的盐酸中和,消耗盐酸的体积相同 |
 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等.下列说法正确的是( )| A、元素Q的非金属性比R的强 |
| B、离子半径的大小顺序:r(Tm+)>r(Wn-) |
| C、元素Q的氧化物均为酸性氧化物 |
| D、元素T与元素R的最高正价之和等于8 |
己烷的同分异构体共有多少种( )
| A、4 | B、5 | C、6 | D、7 |
下列各化合物的命名中不正确的是( )
| A、CH2=CH-CH=CH2 1,3-丁二烯 |
B、 3-丁醇 3-丁醇 |
C、 邻-甲基苯酚 邻-甲基苯酚 |
D、 2-甲基丁烷 2-甲基丁烷 |
下列离子方程式正确的是( )
| A、工业制取漂白粉:2Cl2+4OH-=2Cl-+2ClO-+2H2O | ||
B、向NaOH溶液中滴加同浓度的少量Ca(HCO3)2溶液:Ca2++HCO
| ||
| C、硫酸亚铁加过氧化氢溶液:Fe2++H2O2+2H+═Fe3++4H2O | ||
| D、铝粉与NaOH的D2O溶液反应:2Al+2OH-+2D2O═2AlO2-+3D2↑ |