题目内容
15.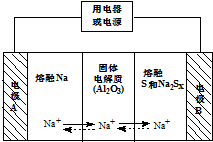 钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)
钠硫电池以熔融金属Na、熔融S和多硫化钠(Na2SX)分别作为两个电极的反应物,多孔固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示:Na2SX$?_{放电}^{充电}$2Na+xS (3<x<5)| 物质 | Na | S | Al2O3 |
| 熔点/℃ | 97.8 | 115 | 2050 |
| 沸点/℃ | 892 | 444.6 | 2980 |
A.100℃以下 B.100℃~300℃C.300℃~350℃D.350℃~2050℃
(2)关于钠硫电池,下列说法正确的是ACD(填字母序号).
A.放电时,电极A为负极
B.放电时,Na+的移动方向为从B到A
C.放电时,负极反应式为 2Na-2e-=2Na+
D.充电时电极B的电极反应式为SX2--2e-=xS
(3)25℃时,若用钠硫电池作为电源电解200mL 0.2mol/L NaCl溶液,当溶液的pH变为l3时,电路中通过的电子的物质的量为0.02mol,两极的反应物的质量差为0.92g.(假设电解前两极的反应物的质量相等且忽略体积变化)
分析 (1)原电池工作时,控制的温度应为满足Na、S为熔融状态;
(2)Na被氧化,应为原电池负极,阳离子向正极移动,充电时,阳极反应为原电池正极反应的逆反应,应生成S,以此解答;
(3)电解NaCl溶液的反应式为,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,每生成2molNaOH转移电子2mol,当溶液的pH变为l3时,c(OH-)=0.1mol/L,生成NaOH物质的量为0.02mol,转移电子0.02mol;据转移电子数计算质量变化.
解答 解:(1)原电池工作时,控制的温度应为满足Na、S为熔融状态,则温度应高于115℃而低于444.6℃,只有c符合,故答案为:C;
(2)A、放电时,Na被氧化,应为原电池负极,故A正确;
B、阳离子向正极移动,即从A到B,故B错误;
C、A为负极,放电时发生氧化反应,2Na-2e-=2Na+,故C正确;
D、充电时,是电解池反应,B为阳极,阳极反应为:Sx2--2e-=xS,故D正确;
故答案为:ACD;
(3)电解NaCl溶液的反应式为,2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,每生成2molNaOH转移电子2mol,当溶液的pH变为l3时,c(OH-)=0.1mol/L,溶液的体积为200mL,所以生成NaOH物质的量为0.02mol,转移电子0.02mol;转移0.02mol电子,负极Na质量减少0.46,正极质量变化0.46g,两极的反应物的质量差为0.92g,
故答案为:0.02;0.92.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理以及电极方程式的书写,答题时注意体会,难度不大.

| A. | 冰 | B. | 过氧化钠 | C. | 氯化钠 | D. | 白磷 |
| A. | 1H和2H是不同的核素,它们的中子数相同 | |
| B. | 6Li和7Li的质子数相等,电子数也相等 | |
| C. | 14C和14N的质子数不等,它们的中子数相等 | |
| D. | 13C和14C属于同一种元素,它们的质量数相等 |
| A. | 麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原性二糖 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同素异形体 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2CrO4溶液混合后会有Ag2CrO4沉淀产生 |
| A. | 工作时Zn 电极质量减少 | B. | Zn 是负极,Ag2O 是正极 | ||
| C. | 工作时溶液中电子由Ag2O 流向Zn | D. | 溶液中氢氧根离子向Zn 电极移动 |
| A. | CO和N2 | B. | O3和NO2- | C. | N2H4和C2H4 | D. | CO2和N2O |
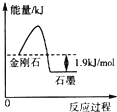 根据表中的信息判断下列说法错误的是( )
根据表中的信息判断下列说法错误的是( )| 物质 | 外观 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色、透明固体 | 395.4 |
| 石墨 | 灰黑,不透明固体 | 393.5 |
| A. | 由表中信息可得如图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol-1 | |
| C. | 由表中信息可知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)═CO(g)△H=-393.5 kJ•mol-1 |
 铜是人类最早利用的金属之一,铜能形成多种重要的化合物.
铜是人类最早利用的金属之一,铜能形成多种重要的化合物. 已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子.
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素.A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子. .
.