��Ŀ����
5��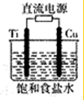 ͭ�������������õĽ���֮һ��ͭ���γɶ�����Ҫ�Ļ����
ͭ�������������õĽ���֮һ��ͭ���γɶ�����Ҫ�Ļ������1������ͭ��;֮һ���Ʊ���·�壬�Ʊ���·��ʱ�ĸ�ʴҺ��FeCl3��д���Ʊ���·��ʱ��Ӧ�����ӷ���ʽ��2Fe3++Cu=2Fe2++Cu2+��
��2���ڼ��������£����Ƶ�Cu��OH��2��Һ�����ڼ����Һ���Ƿ��������ǣ���������ɫ������ʱ��������Һ�к��������ǣ�����Һ�в���������ʱ������ʱ�������к�ɫ������֣�ԭ����Cu��OH��2�ֽ����ɺ�ɫ��CuO��
��3����֪����ʱ��Ksp��CuCl��=1.2��10-6��Ksp��CuI��=1.1��10-12��������Cu2+��I2����CuCl2��Һ�еμӹ�����KI��Һ���˹����з�����������ԭ��Ӧ�����ӷ���ʽΪ��2Cu2++2Cl-+2I-�T2CuCl��+I2 ��2Cu2++4I-=2CuI��+I2����ͬѧ��Ϊ���յij�������û��CuCl���������˽��۵�����������KI����������CuI�ܶȻ�ԶԶС��CuCl��
��4��CuH��һ�ֺ���ɫ���壬���ȶ������ڿ�������������������ȼ�գ���65��ʱ�������ᣨH3PO2���ӵ� CuSO4��Һ�ɵõ�CuH��
��CuH��������ȼ��ʱ�IJ�����2CuH+3Cl2=2CuCl2+2HCl��
��������л�ѧ����ʽ��3H3PO2+4CuSO4+6H2O�T4CuH��+3H3PO4+4H2SO4
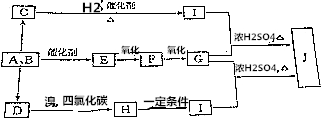
��5������Cu2O��һ����;�㷺�Ĺ����ϣ��Ʊ�����ԭ��֮һ��ͼ��ʾ��
�����ϵĵ缫��ӦʽΪ2Cu-2e-+H2O=Cu2O+2H+���������У���Һ��pH�仯����Dz��䣨����������䡱�����pС������ȷ�����������ʱ�ܷ�Ӧ����ʽΪH2O+2Cu $\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2����
���� ��1���Ȼ�����Һ�͵�·���ϵ�ͭ��Ӧ�����Ȼ��������Ȼ�ͭ��
��2���ڼ��������£������������Ƶ�������ͭ��Ӧ����������ͭ��ɫ������������ͭ�����ֽ⣻
��3��CuI�ܶȻ�ԶԶС��CuCl����Ӧ����CuI������ͭ���ӱ���ԭ�������ӱ���������I2������KI����������CuI�ܶȻ�ԶԶС��CuCl��
��4����CuH������Ԫ�ؾ�Ϊ�ͼ�̬����������Ӧ���ɸ�̬���
�ڸ���������ԭ��Ӧ�е�ʧ�������������ƽ������ԭ��Ӧ�ķ���ʽ��
��5��ͭΪ����������������Ӧ����Cu2O���缫����ʽΪ2Cu-2e-+H2O=Cu2O+2H+��TiΪ�����������������ӵõ��������������ݴ˷�����
��� �⣺��1��FeCl3��Һ��ʴ��·������ӷ���ʽΪ��2Fe3++Cu=2Fe2++Cu2+���ʴ�Ϊ��2Fe3++Cu=2Fe2++Cu2+��
��2���ڼ��������£������������Ƶ�������ͭ��Ӧ����������ͭ��ɫ��������������ɫ������ʱ��������Һ�к��������ǣ�������ͭ�����ֽ����ɺ�ɫ��CuO��
�ʴ�Ϊ���죻Cu��OH��2�ֽ����ɺ�ɫ��CuO��
��3��CuI�ܶȻ�ԶԶС��CuCl����Ӧ����CuI������ͭ���ӱ���ԭ�������ӱ���������I2��CuCl2��Һ��KI��Һ��Ӧ�����ӷ���ʽΪ��2Cu2++4I-=2CuI��+I2��
����KI����������CuI�ܶȻ�ԶԶС��CuCl���������ɵ�CuCl��ת��ΪCuI��
�ʴ�Ϊ��2Cu2++4I-=2CuI��+I2������KI����������CuI�ܶȻ�ԶԶС��CuCl��
��4����CuH��������ȼ�������Ȼ�����Ȼ�ͭ������ʽΪ2CuH+3Cl2=2CuCl2+2HCl��
�ʴ�Ϊ��2CuH+3Cl2=2CuCl2+2HCl��
�ڷ�Ӧ��PԪ�صĻ��ϼ���+1�����ߵ�+5�ۣ�CuԪ�صĻ��ϼ���+2�۽��͵�+1�ۣ�HԪ�صĻ��ϼ���+1�۽��͵�-1�ۣ�����1��CuH�õ�3�����ӣ�����1��H3PO4ʧȥ4�����ӣ����ݵ�ʧ������Ŀ��ȿ�֪��������֮��Ϊ4��3�����������غ㶨�ɿ�֪ȱ��ˮ����ѧ����ʽΪ��3H3PO2+4CuSO4+6H2O�T4CuH��+3H3PO4+4H2SO4��
�ʴ�Ϊ��3��4��6H2O��4��3��4H2SO4��
��5��ͭΪ������Cuʧ���ӷ���������Ӧ����Cu2O���缫����ʽΪ2Cu-2e-+H2O=Cu2O+2H+��TiΪ�����������������ӵõ����������������ܷ�ӦΪH2O+2Cu $\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2������Һ��������Ũ�Ȳ��䣬����pH���䣻
�ʴ�Ϊ��2Cu-2e-+H2O=Cu2O+2H+�����䣻H2O+2Cu $\frac{\underline{\;ͨ��\;}}{\;}$Cu2O+H2����
���� ���⿼����ͭ�Ļ���������ʣ���Ŀ�Ѷ��еȣ���Ŀ�漰������ԭ��Ӧ�����ӷ���ʽ����д�����ԭ����Ӧ�õȣ������ڿ���ѧ���ķ��������ͶԻ���֪ʶ���ۺ�Ӧ��������

| A�� | �٢ڢۢ� | B�� | �٢ڢ� | C�� | �ݢޢ� | D�� | �ۢܢݢ� |
| A�� |  �Ƚ�Cl2��Br2��I2�����������ǿ�� | B�� |  ̽���ռ��ܽ�ʱ����ЧӦ | ||
| C�� | 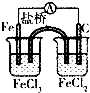 ����ѧ��ת��Ϊ���� | D�� |  ����һ�����ʵ���Ũ�ȵ���Һ |
| A�� | ��Ӧ�������е����������������������е������� | |
| B�� | ���տ�����0.2 mol NH3 | |
| C�� | ��Ӧ��ƽ���ʹ�ô���������ʹƽ�������ƶ� | |
| D�� | ��n��N2����n��H2��=1��3ʱ��һ���ﻯѧƽ�� |
| A�� | ��ѧ��Ӧ�������ۿ�ָ��������һ��ʱ���ڿ����Ʒ | |
| B�� | ��ѧƽ�����ۿ�ָ������ʹ������ԭ�϶����Ʒ | |
| C�� | ����Ӧ�ﵽ��ʱ���������������α仯����Ӧ��ϵ�ڸ����ʺ���ʼ�ղ��� | |
| D�� | ��ȷ���û�ѧ��Ӧ���ʺͻ�ѧƽ�����۶���������������ۺϾ���Ч�� |
| �¶�/�� | 25 | t1 | t2 |
| ˮ�����ӻ����� | 1��10-14 | �� | 1��10-12 |
����25��t1��t2�������1��10-14���������������=����
��25���£�ijNa2SO4��Һ��c��SO42-��=1.0��10-4 mol•L-1��ȡ����Һ1mL����ˮϡ����10mL����ϡ�ͺ���Һ��c ��Na+����c ��OH-��=1000��1
��t2���£���pH=11�Ŀ�������ҺV1 L��pH=1��ϡ����V2 L��ϣ����Ϻ���Һ�����Ϊԭ����Һ���֮�ͣ������û����Һ��pH=6����V1��V2=1��1������Һ�и������ӵ�Ũ���ɴ�С������˳����c��Na+��=2c��SO42-����c��H+��=c��OH-����
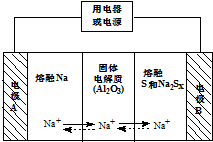 �����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ���ԭ����ͼ��ʾ��Na2SX$?_{�ŵ�}^{���}$2Na+xS ��3��x��5��
�����������ڽ���Na������S�Ͷ����ƣ�Na2SX���ֱ���Ϊ�����缫�ķ�Ӧ������Al2O3�մɣ��ɴ���Na+��Ϊ����ʣ���ԭ����ͼ��ʾ��Na2SX$?_{�ŵ�}^{���}$2Na+xS ��3��x��5��| ���� | Na | S | Al2O3 |
| �۵�/�� | 97.8 | 115 | 2050 |
| �е�/�� | 892 | 444.6 | 2980 |
A��100������ B��100�桫300��C��300�桫350��D��350�桫2050��
��2�����������أ�����˵����ȷ����ACD������ĸ��ţ���
A���ŵ�ʱ���缫AΪ����
B���ŵ�ʱ��Na+���ƶ�����Ϊ��B��A
C���ŵ�ʱ��������ӦʽΪ 2Na-2e-=2Na+
D�����ʱ�缫B�ĵ缫��ӦʽΪSX2--2e-=xS
��3��25��ʱ��������������Ϊ��Դ���200mL 0.2mol/L NaCl��Һ������Һ��pH��Ϊl3ʱ����·��ͨ���ĵ��ӵ����ʵ���Ϊ0.02mol�������ķ�Ӧ���������Ϊ0.92g����������ǰ�����ķ�Ӧ�����������Һ�������仯��