题目内容
4.X、Y是短周期元素,且X的原子序数比Y大4.请填空:I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料.
(1)元素Y在元素周期表的位置为第二周期VIA族.
(2)粉末状X是制造烟花的重要原料之一,生产粉末状X时,将X蒸气在某种气体中冷却.下列可作为冷却气体的是D.A.空气 B.氮气 C.氩气 D.二氧化碳
II.若X是短周期最活泼的金属元素.
(3)Y2H4、O2与XOH溶液组成的电池,其负极的电极反应式(已知:Y2H4可以和O2反应生成Y2和H2O)为N2H4+4OH-+4e-=N2+4H2O.该电池中OH-移向氟极.
(4)25℃时,往a mol•L-1 YH3的水溶液(甲)中滴加0.01mol•L-1H2SO4溶液(乙),滴加过程中溶液的导电能力增强(填“增强”、“减弱”或“不变”),当甲与乙等体积混合后,溶液呈中性(设温度不变),甲中溶质的电离常数Kb=$\frac{2}{a-0.02}$×10-9(填表达式,用含a的代数式表示).
分析 X、Y是短周期元素,且X的原子序数比Y大4.
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料,则X为Mg、Y为O;
II.若X是短周期最活泼的金属元素,则X为Na,Y为N.
(3)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极失去电子,生成氮气与水;原电池电解质溶液中阴离子向负极移动,阳离子向正极移动;
(4)一水合氨与硫酸反应生成硫酸铵,溶液中离子浓度增大;等体积混合后溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L,硫酸根为0.005mol/L,根据电荷守恒计算c(NH4+),再根据物料守恒(N元素守恒)计算溶液中c(NH3.H2O),代入Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$计算.
解答 解:X、Y是短周期元素,且X的原子序数比Y大4.
I.若X是金属元素,Y是非金属元素,化合物XY是优质的耐高温材料,则X为Mg、Y为O.
(1)元素Y为氧,在元素周期表的位置为:第二周期VIA族,故答案为:第二周期VIA族;
(2)氧气、二氧化碳、氮气都能与Mg蒸气反应,可以用氩气作为冷却气体,故答案为:D;
II.若X是短周期最活泼的金属元素,则X为Na,Y为N.
(3)N2H4、O2与NaOH溶液组成的电池,负极发生氧化反应,N2H4在负极失去电子,生成氮气与水,负极电极反应式为:N2H4+4OH-+4e-=N2+4H2O;原电池中OH-移向负极,
故答案为:N2H4+4OH-+4e-=N2+4H2O;负;
(4)一水合氨与硫酸反应生成硫酸铵,溶液中离子浓度增大,滴加过程中溶液的导电能力增强,
等体积混合后溶液呈中性,则溶液中c(H+)=c(OH-)=10-7mol/L,硫酸根为0.005mol/L,根据电荷守恒:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),则c(NH4+)=2c(SO42-)=0.01mol/L,根据物料守恒(N元素守恒):c(NH4+)+c(NH3.H2O)=0.5a mol/L,则c(NH3.H2O)=(0.5a-0.01)mol/L,故电离平衡常数Kb=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{0.01×1{0}^{-7}}{(0.5a-0.01)}$=$\frac{2}{a-0.02}$×10-9,
故答案为:增强;$\frac{2}{a-0.02}$×10-9.
点评 本题比较综合,涉及元素推断、原电池、电离平衡常数计算等,(4)中关键是利用电荷守恒与物料守恒计算离子浓度,是对基础知识与学生综合能力的考查.

 阅读快车系列答案
阅读快车系列答案| A. | 酸性氧化物都可以与强碱溶液反应 | |
| B. | 与水反应生成酸的氧化物都是酸性氧化物 | |
| C. | 金属氧化物都是碱性氧化物或两性氧化物 | |
| D. | 不能与酸反应的氧化物一定能与碱反应 |
| A. | 溶液的质量 | B. | 水的离子积 | C. | OH-物质的量浓度 | D. | 溶液pH值 |
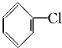 制取
制取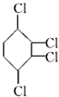 ,其合成流程如下:
,其合成流程如下:
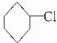 .
. ,
,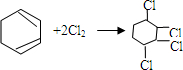 .
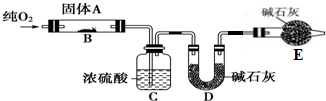
.
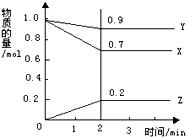 某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).
某温度下,在2L的密闭容器中,X、Y、Z三种物质随时间变化的曲线如图所示.由图中数据分析:该反应的化学方程式为:X+3Y?2Z.反应开始至2min,Z的平均反应速率为0.05mol/(L.min).