题目内容
9.实验室用燃烧法测定某固体有机物A的分子组成.测定装置如图所示(铁架台、铁夹、酒精灯等未画出):取17.1g A放入装置中,通入过量O2燃烧,生成CO2和H2O,请回答下列有关问题: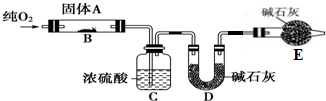
(1)通入过量O2的目的是使有机物A充分燃烧.
(2)C装置的作用是吸收A燃烧后生成的H2O,测定生成水的质量; E装置的作用是吸收空气中二氧化碳与水蒸气,防止进入D中.
(3)通过该实验,能否确定A中是否含有氧原子?能.(填“能”或“不能”)
(4)若A的摩尔质量为342g•mol-1,C瓶增重9.9g,D装置增重26.4g,则A的分子式为C12H22O11.
(5)写出A完全燃烧的化学方程式C12H22O11+12O2$\stackrel{点燃}{→}$12CO2+11H2O.
分析 (1)(2)有机物A完全燃烧生成CO2和H2O,通过测定生成的CO2、H2O的量确定实验式,用浓硫酸吸收水蒸气,用碱石灰吸收二氧化碳,E中碱石灰吸收空气中二氧化碳与水蒸气,防止进入D中影响二氧化碳质量测定.由于装置内有空气,会影响水蒸气、二氧化碳质量测定,实验开始时,要先通入氧气排尽装置内空气;
(3)计算生成水、二氧化碳的物质的量,根据质量守恒判断是否含有O元素;
(4)浓硫酸增重为水的质量,D中碱石灰增重为二氧化碳质量,计算有机物A、水、二氧化碳的物质的量,根据原子守恒计算C、H原子说明,结合相对分子质量计算氧原子数目,进而确定有机物分子式;
(5)有机物在氧气中燃烧生成二氧化碳和水,结合原子守恒配平书写方程式.
解答 解:(1)燃烧法测定某固体有机物A的分子组成,要通入过量O2使有机物在氧气中充分燃烧生成二氧化碳和水,
故答案为:使有机物A充分燃烧;
(2)C装置中的试剂为浓硫酸,用于吸收有机物燃烧生成的水,测定生成水的质量,D装置中的试剂是碱石灰用于吸收有机物燃烧生成的二氧化碳,测定生成二氧化碳的质量,E中碱石灰吸收空气中二氧化碳与水蒸气,防止进入D中影响二氧化碳质量测定
故答案为:吸收A燃烧后生成的H2O,测定生成水的质量;吸收空气中二氧化碳与水蒸气,防止进入D中;
(3)通过浓硫酸增重的质量可以求出有机物中氢的质量,通过碱石灰增重的质量可以求出有机物中碳的质量,再结合A的质量利用质量守恒判断是否有氧元素,
故答案为:能;
(4)17.1g有机物A的物质的量为$\frac{17.1g}{342g/mol}$=0.05mol,生成水的物质的量为$\frac{9.9g}{18g/mol}$=0.55mol,生成二氧化碳为$\frac{26.4g}{44g/mol}$=0.6mol,则有机物A分子中N(C)=$\frac{0.6mol}{0.05mol}$=12,N(H)=$\frac{0.55mol×2}{0.05mol}$=22,则N(O)=$\frac{342-12×12-22}{16}$=11,所以Ad分子式也为C12H22O11,
故答案为:C12H22O11;
(5)C12H22O11在氧气中燃烧生成二氧化碳和水,其反应的方程式为:C12H22O11+12O2$\stackrel{点燃}{→}$12CO2+11H2O;
故答案为:C12H22O11+12O2$\stackrel{点燃}{→}$12CO2+11H2O.
点评 本题考查有机物分子式计算、物质组成定量测定实验,难度中等,理解实验原理是解题的关键,掌握燃烧法确定有机物分子式方法.

| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | |
| B. | C6H6十Br2$\stackrel{Fe}{→}$C6H5Br+HBr | |
| C. | CH2═CH2+Br2CH2Br-CH2Br | |
| D. | CH3COOH+CH3CH2OH$→_{加热}^{浓硫酸}$CH3COOCH2CH3+H2O |
| A. | SO2使品红溶液褪色 | |
| B. | 浓硫酸暴露在空气中会增重 | |
| C. | 常温下,可用铁、铝制容器来盛装浓硫酸或浓硝酸 | |
| D. | 氨气遇到氯化氢气体冒“白烟” |
| A. | 1 g Na2CO3 | B. | 0.1mol CaCO3 | C. | 56 g Fe | D. | 10 mLH2O |
| A. | 酸性:HClO4>H2SO4>H3PO4>H2SiO3 | B. | 碱性:KOH>NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 热稳定性:H2S>H2O>PH3>NH3 | D. | 原子半径:Na>S>O>F |
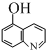 )是白色或淡黄色粉末,可通过如下实验步骤制得:
)是白色或淡黄色粉末,可通过如下实验步骤制得: