题目内容
3.如图是元素周期表前四周期的一部分,关于元素X、Y、Z的叙述错误的是( )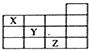
| A. | X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 | |
| B. | 等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z | |
| C. | Z的单质常温下是液体,可与铁粉反应 | |
| D. | Z的原子序数比Y大9 |
分析 如图是元素周期表前四周期的一部分,根据元素在周期表中的位置知,X是N元素、Y是S元素、Z是Br元素,
A、氮的氢化物是氨气呈碱性,硫的最高价氧化物是硫酸;
B、X、Y、Z的气态氢化物分别是氨气、硫化氢、氢溴酸,氨气水溶液呈碱性、氢硫酸是弱酸,而氢溴酸是强酸;
C、溴单质常温下是液体,具有氧化性;
D、Br的原子序数为35,而Y是16.
解答 解:A、氮的氢化物是氨气呈碱性,硫的最高价氧化物是硫酸,两者反应生成硫酸铵或硫酸氢铵都是盐,故A正确;
B、X、Y、Z的气态氢化物分别是氨气、硫化氢、氢溴酸,氨气水溶液呈碱性、氢硫酸是弱酸,而氢溴酸是强酸,所以等物质的量浓度的X、Y、Z的气态氢化物的水溶液的pH:X>Y>Z,故B正确;
C、溴单质常温下是液体,具有氧化性,与铁反应生成溴化铁,故C正确;
D、Br的原子序数为35,而Y是16,原子序数大19,故D错误;
故选D.
点评 本题考查了元素周期表和元素周期律的综合应用,熟悉元素周期表结构并正确推断元素是解本题关键,再结合元素周期律来分析解答,题目难度不大.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案
相关题目
13.一定温度下,在固定体积的密闭容器中发生下列反应:2HI(g)=H2(g)+I2(g)若c(HI) 由0.1mol/L
降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应时间为( )
降到0.07mol/L时,需要15s,那么c(HI)由0.07mol/L降到0.05mol/L时,所需反应时间为( )
| A. | 等于5s | B. | 等于10s | C. | 大于10s | D. | 小于10s |
14.化学与社会、生产、生活密切相关.下列说法不正确的是( )
| A. | 硅胶可用作食品干燥剂 | B. | 乙醇可作消毒剂 | ||
| C. | 氢氧化铝可作胃酸中和剂 | D. | 二氧化碳可作钠着火的灭火剂 |
18.在生活、生产及化学研究中,人们经常需要根据不同原子、分子或离子的某些特征反应对物质进行检验,以确定物质的组成.下列有关物质检验的说法正确的是( )
| A. | MnO2、CuO、Fe三种物质的粉末都是黑色的,用稀盐酸不能将它们区别开 | |
| B. | (NH4)2SO4、K2SO4、NH4C1三种物质不能用一种试剂通过化学反应区别开 | |
| C. | 可以用BaCl2溶液和稀硝酸检验Na2SO3 是否变质 | |
| D. | 用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
8.X、Y、Z、W、R属于短周期主族元素,X的原子半径是短周期主族元素中最大的,Y元素的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数为m-n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1.下列叙述正确的是( )
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
15.下列说法不正确的是( )
| A. | 质子数相同的粒子一定属于同一种元素 | |
| B. | 同一元素的核素种数由中子数决定 | |
| C. | 同位素的化学性质几乎相同 | |
| D. | 质子数相同、电子数也相同的两种粒子,不可能是一种分子和一种离子 |
12.A元素的阳离子与B元素的阴离子具有相同的电子层结构,下列有关两元素的叙述中正确的是( )
①原子半径:A<B
②离子半径:A>B
③原子序数:A>B
④第一电离能:A>B
⑤A的正价与B的负价绝对值一定相等
⑥电负性:A<B.
①原子半径:A<B
②离子半径:A>B
③原子序数:A>B
④第一电离能:A>B
⑤A的正价与B的负价绝对值一定相等
⑥电负性:A<B.
| A. | ③⑥ | B. | ①② | C. | ③⑤ | D. | ③④⑤⑥ |
13.下列说法正确的是( )
| A. | 乙酸和甲酸甲酯互为同分异构体 | |
| B. | H2和D2互为同素异形体 | |
| C. | CH3CH2OH与HOCH2CH2CH2OH互为同系物 | |
| D. | 35Cl与37Cl为同一种核素 |
 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题: