题目内容
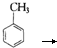
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,设计了如图所示的实验装置,试按要求回答问题.
(1)写出装置A中反应的离子方程式 ;
(2)①装置B中盛放的试剂名称为 ,装置C的作用是 ;
②装置D和E中出现的不同现象说明的问题是 ;
(3)F装置的作用是 ;
(4)若装置G中出现白色沉淀,该实验现象能否说明A中制备出的Cl2中含有HCl气体 (填“能”或“不能”).

(1)写出装置A中反应的离子方程式
(2)①装置B中盛放的试剂名称为
②装置D和E中出现的不同现象说明的问题是
(3)F装置的作用是
(4)若装置G中出现白色沉淀,该实验现象能否说明A中制备出的Cl2中含有HCl气体
考点:氯、溴、碘的性质实验
专题:实验题
分析:(1)MnO2和浓盐酸在加热条件下发生反应生成氯化锰和氯气、水;
(2)①依据实验的目的探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,结合硫酸铜遇水变蓝的性质解答;由于装置D是检验氯气能否使干燥的有色布条褪色,故装置C的作用是干燥氯气;
②干燥的氯气不能使有色物质褪色,氯气不具有漂白性;
(3)氯气易溶于四氯化碳,用四氯化碳吸收氯气,防止干扰F中氯气中含有的氯化氢的检验;
(4)氯气被四氯化碳吸收,通入硝酸银溶液的是HCl气体.
(2)①依据实验的目的探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,结合硫酸铜遇水变蓝的性质解答;由于装置D是检验氯气能否使干燥的有色布条褪色,故装置C的作用是干燥氯气;
②干燥的氯气不能使有色物质褪色,氯气不具有漂白性;
(3)氯气易溶于四氯化碳,用四氯化碳吸收氯气,防止干扰F中氯气中含有的氯化氢的检验;
(4)氯气被四氯化碳吸收,通入硝酸银溶液的是HCl气体.
解答:
解:(1)MnO2和浓盐酸在加热条件下发生反应生成氯化锰和氯气、水,化学方程式是:MnO2+4HCl
MnCl2+Cl2↑+2H2O,离子方程式为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O,;
(2)①依据实验的目的探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,而硫酸铜遇水变蓝,故试剂B为无水硫酸铜;由于装置D是检验氯气能否使干燥的有色布条褪色,故装置C的作用是干燥氯气,故答案为:无水硫酸铜;干燥氯气;
②D中干燥的布条不褪色,E中湿润的布条褪色说明干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性,
故答案为:干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性;
(3)氯气易溶于四氯化碳,用四氯化碳吸收氯气,防止干扰F中氯气中含有的氯化氢的检验,
故答案为:吸收氯气;
(4)氯气被四氯化碳吸收,故通入硝酸银溶液产生沉淀的是HCl气体,故答案为:能.
| ||
| △ |
| ||
| △ |
故答案为:MnO2+4H++2Cl-
| ||
| △ |
(2)①依据实验的目的探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,而硫酸铜遇水变蓝,故试剂B为无水硫酸铜;由于装置D是检验氯气能否使干燥的有色布条褪色,故装置C的作用是干燥氯气,故答案为:无水硫酸铜;干燥氯气;
②D中干燥的布条不褪色,E中湿润的布条褪色说明干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性,
故答案为:干燥的氯气无漂白性,潮湿的氯气(或次氯酸)有漂白性;
(3)氯气易溶于四氯化碳,用四氯化碳吸收氯气,防止干扰F中氯气中含有的氯化氢的检验,
故答案为:吸收氯气;
(4)氯气被四氯化碳吸收,故通入硝酸银溶液产生沉淀的是HCl气体,故答案为:能.
点评:本题考查氯气的制取原理、实验装置评价与理解、氯气的性质、氯离子检验等,难度不大,关键是清楚实验的目的与原理.

练习册系列答案
相关题目
常温下,用0.1000mol/L的HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如下图.下列说法不正确的是( )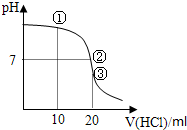

| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(H+)>c(NH3?H2O)>c(OH-) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出H2最多的是( )
| A、2mol/L H2SO4溶液 |
| B、3mol/L CuSO4溶液 |
| C、6mol/L KOH溶液 |
| D、3mol/L Ba(OH)2溶液 |



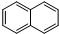 )的衍生物;
)的衍生物;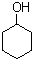 为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
为原料制备化合物B的合成路线流程图(无机试剂任选).合成路线流程图示例如下:H2C═CH2
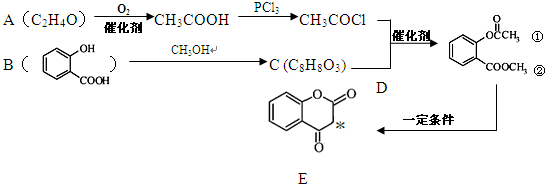
 )是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.
)是一种重要的有机合成中间体.写出以苯酚、甲苯为基本原料制取该化合物的合成路线流程图.请注意:1.可选用必要的无机原料;2.已知酚羟基一般不易直接与羧酸发生类似酯化的反应,以上C→D的方法可供参照.