题目内容
常温下,用0.1000mol/L的HCl溶液滴定20.00mL 0.1000mol/L NH3?H2O溶液,滴定曲线如下图.下列说法不正确的是( )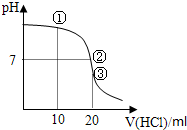

| A、①溶液:c(C1-)>c(NH4+)>c(OH-)>c(H+) |
| B、②溶液:c(NH4+)=c(C1-)>c(OH-)=c(H+) |
| C、③溶液:c(H+)>c(NH3?H2O)>c(OH-) |
| D、滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+) |
考点:酸碱混合时的定性判断及有关ph的计算
专题:电离平衡与溶液的pH专题
分析:由图可知,酸滴定碱,pH在减小,③点时等体积等浓度恰好反应生成氯化铵,则①②两点均为氨水与氯化铵的溶液,但②点pH=7,结合电离、水解来解答.
解答:
解:A.①点反应后为等物质的量的NH4Cl、NH3?H2O,电离大于水解,溶液显碱性,则c(OH-)>c(H+),一水合氨电离使c(NH4+)>c(C1-),故A错误;
B.②点反应后为溶液含NH4Cl、NH3?H2O,pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(NH4+)=c(C1-),则c(NH4+)=c(C1-)>c(OH-)=c(H+),故B正确;
C.③点时等体积等浓度恰好反应生成氯化铵,水解显酸性,且水电离生成氢离子,则c(H+)>c(NH3?H2O)>c(OH-),故C正确;
D.在滴定的初始阶段,加盐酸很少,则氨水的量远大于生成的NH4Cl,且溶液显碱性,则c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选A.
B.②点反应后为溶液含NH4Cl、NH3?H2O,pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(NH4+)=c(C1-),则c(NH4+)=c(C1-)>c(OH-)=c(H+),故B正确;
C.③点时等体积等浓度恰好反应生成氯化铵,水解显酸性,且水电离生成氢离子,则c(H+)>c(NH3?H2O)>c(OH-),故C正确;
D.在滴定的初始阶段,加盐酸很少,则氨水的量远大于生成的NH4Cl,且溶液显碱性,则c(NH3?H2O)>c(NH4+)>c(OH-)>c(Cl-)>c(H+),故D正确;
故选A.
点评:本题考查酸碱混合的定性判断及离子浓度大小比较,为高频考点,综合考查学生的分析能力和化学基本理论的运用能力,注意混合溶液溶质的判断及水解、电离程度,题目难度中等,注意溶液为中性的点盐酸的体积小于20mL.

练习册系列答案
相关题目
已知,mg Al在足量氯气中燃烧,生成固体的质量为(m+21.3)g,若将mgAl投入总质量为95.2g的NaOH水溶液中恰好完全反应,则所得溶液中溶质的质量分数为( )
| A、5.4% | B、8.0% |
| C、16.3% | D、16.4% |
 -OH和
-OH和 CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.
CH2OHE.NH2CH2COOH与NH2CH(CH3)COOHF.CH3CHO与CH2=CHCHO.