题目内容
16.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性.下列说法正确的是( )| A. | W与X形成的化合物溶于水后溶液呈碱性 | |
| B. | 简单离子半径:W<X<Z | |
| C. | 气态氢化物的热稳定性:W<Y | |
| D. | 最高价氧化物的水化物的酸性:Y>Z |
分析 四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na.由原子序数可知,Y、Z处于第三周期,而Z与X(钠)形成的离子化合物的水溶液呈中性,则Z为Cl.W、X的简单离子具有相同电子层结构,且W与Y同族,W在第二周期且是非金属元素,W可能是氮(或)氧,则对应的Y为磷(或硫).
解答 解:四种短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是短周期主族元素原子中最大的,则X为Na.由原子序数可知,Y、Z处于第三周期,而Z与X(钠)形成的离子化合物的水溶液呈中性,则Z为Cl.W、X的简单离子具有相同电子层结构,且W与Y同族,W在第二周期且是非金属元素,W可能是氮(或)氧,则对应的Y为磷(或硫).
A.W可能是氮或氧,与钠形成的化合物可能是氮化钠,氧化钠,过氧化钠,它们与水反应都能生成氢氧化钠使溶液呈碱性,故A正确;
B.X离子(Na+)、W离子的电子层为2层,Z离子(Cl-)电子层为3层,电子层结构相同,核电荷数越大离子半径越小,离子电子层越多离子半径越大,故简单离子半径大小顺序是:X<W<Z,故B错误;
C.W与Y处于同于主族,从上到下非金属性逐渐减弱,气态氢化物的热稳定性:W>Y,故C错误;
D.Y与Z处于同同期,从左到右非金属性逐渐增强,最高价氧化物的水化物的酸性:Z>Y,故D错误.
故选:A.
点评 本题考查结构性质位置关系应用,侧重对元素周期律的考查,正确推断各元素为解答关键,注意元素的不确定性,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 导学与测试系列答案
导学与测试系列答案 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案
相关题目
6.将含有0.4molNaCl和0.4molCu(NO3)2的水溶液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另一个电极上放出气体的体积(标准状况)约为( )
| A. | 6.72L | B. | 5.6L | C. | 2.8L | D. | 13.44L |
11.下列有关实验的操作和结论正确的是( )
| A. | 明矾和漂白粉均可用于自来水的杀菌、消毒 | |
| B. | 用丁达尔实验可以将Al(OH)3胶体和NaCl溶液区分 | |
| C. | CCl4萃取碘水中的I2,先从分液漏斗下口放出有机层,后从分液漏斗下口放出水层 | |
| D. | 浓盐酸与MnO2反应制备纯净Cl2,气体产物先通过浓硫酸,后通过饱和食盐水 |
1.下列有关物质性质的应用正确的是( )
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 氯化钠是电解质,可电解其水溶液获得金属钠 | |
| C. | SO2有还原性,常用来漂白纸浆 | |
| D. | 四氯化碳密度比水大,可用于萃取溴水中的溴 |
8.如图为氢氧燃料电池的构造示意图.下列说法不正确的是( )
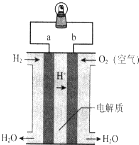

| A. | a电极是正极 | B. | 电流由b通过灯泡流向a | ||
| C. | 该电池总反应是2H2+O2═2H2O | D. | 该装置可将化学能转化为电能 |
5.等温、等压下,Ag CO2所占的体积为11.2L,0.5A g X的气体所占的体积为7.7L,则气体的相对分子质量为( )
| A. | 16 | B. | 32 | C. | 48 | D. | 64 |
9.下列化学用语正确的是( )
| A. | K+的结构示意图: | B. | 四氯化碳的电子式: | ||
| C. | CH4分子的比例模型: | D. | 过氧化氢结构式:H-O-O-H |