题目内容
8.向200mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,过滤、加热并灼烧直至质量不再变化,此时固体的质量可能为( )| A. | 1.60 g | B. | 2.76 g | C. | 4.36 g | D. | 5.54 g |
分析 Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+完全沉淀,得到硝酸钠与氢氧化亚铁,过滤,小心加热沉淀,再灼烧至质量不再变化,由于氢氧化亚铁易被氧化,最终所得固体为Fe2O3,由Fe原子守恒可知:n[Fe(NO3)2]=2n(Fe2O3),再根据m=nM计算.
解答 解:Fe(NO3)2溶液中加入适量的NaOH溶液,使Fe2+完全沉淀,得到硝酸钠与氢氧化亚铁,过滤,加热、蒸干并灼烧混合物直至质量不再变化,由于氢氧化亚铁易被氧化,最终所得固体为Fe2O3,
200mL 0.1mol/L的Fe(NO3)2溶液中n[Fe(NO3)2]=0.2L×0.1mol/L=0.02mol,由Fe原子守恒可知:n[Fe(NO3)2]=2n(Fe2O3),所以n(Fe2O3)=$\frac{0.02mol}{2}$=0.01mol,其质量为0.01mol×160g/mol=1.60g,
故选:A.
点评 本题考查化学反应方程式的计算,注意氢氧化亚铁不稳定性,关键是判断最终固体为氧化铁,利用守恒法计算,侧重考查学生分析计算能力,题目难度不大.

练习册系列答案
相关题目
18.利用电化学原理保护钢闸门的某装置如图所示,关于该装置的说法正确的是( )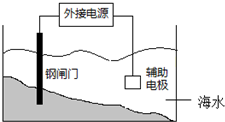

| A. | 钢闸门应与外接电源的负极相连 | |
| B. | 该装置的原理是“牺牲阳极阴极保护法” | |
| C. | 辅助电极材料可用锌 | |
| D. | 阴极的电极反应式:2Cl--2e→Cl2↑ |
19.下列设计的实验方案能达到实验目的是( )
| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
13.新型材料固体碳被称作“纳米泡沫”,纳米泡沫碳与金刚石的关系是( )
| A. | 同系物 | B. | 同分异构体 | C. | 同位素 | D. | 同素异形体 |
20.NA表示阿伏伽德罗常数,下列判断正确的是( )
| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
17.某物质有以下性质:①是电解质,②溶解时有化学键的破坏,③熔化时没有化学键的破坏,则该物质固态时属于( )
| A. | 原子晶体 | B. | 分子晶体 | C. | 离子晶体 | D. | 金属晶体 |
6.NA表示阿伏加德罗常数的值,则下列说法正确的是( )
| A. | 1 摩尔任何物质都含NA个原子 | |
| B. | 0.1 mol/L K2SO4溶液中含有 K+为0.2 NA | |
| C. | 7.1gCl2与足量的氢氧化钠溶液反应转移的电子数一定为0.2NA | |
| D. | 标准状况下,22.4L 以任意比混合的CO、CO2混合气体所含碳原子数约为NA |