题目内容
20.NA表示阿伏伽德罗常数,下列判断正确的是( )| A. | 在20g D2O中含有NA个氧原子 | |
| B. | 标准状况下,2.24 L三氧化硫中所含氧原子数为0.3 NA | |
| C. | 1 molCl2参加反应转移电子数一定为2NA | |
| D. | 含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1 mol/L |
分析 A、求出重水的物质的量,然后根据1mol重水中含1mol氧原子来分析;
B、标况下三氧化硫为固体;
C、氯气参与反应后的价态可能为-1价、还可能为+1价、+3价、+5价和+7价;
D、将氧化钠溶于1L水中后,所得溶液的体积大于1L.
解答 解:A、20g重水的物质的量为1mol,而1mol重水中含1mol氧原子,故含NA个氧原子,故A正确;
B、标况下三氧化硫为固体,故不能根据气体摩尔体积来计算其物质的量和含有的氧原子个数,故B错误;
C、氯气参与反应后的价态可能为-1价、还可能为+1价、+3价、+5价和+7价,还可能发生歧化反应,故1mol氯气参与反应转移的电子数不一定是2NA个,故C错误;
D、将氧化钠溶于1L水中后,所得溶液的体积大于1L,故所得溶液中钠离子的浓度小于1mol/L,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
10.现代生活需要人们有一定的科学素养,下列有关化学的科学常识正确的是( )
| A. | 利用SiO2的导电性来制备光导纤维 | |
| B. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油 | |
| C. | “地沟油”不能食用,但可以加工成肥皂或生物柴油 | |
| D. | 发展新能源汽车的主要目的是为了减少PM2.5的排放 |
8.向200mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,过滤、加热并灼烧直至质量不再变化,此时固体的质量可能为( )
| A. | 1.60 g | B. | 2.76 g | C. | 4.36 g | D. | 5.54 g |
15.下列化学用语正确的( )
| A. | I-131:${\;}_{53}^{77}$I | B. | Cl-的结构示意图: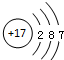 | ||
| C. | 乙炔的结构简式:CHCH | D. | Na2S的电子式: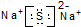 |
5.无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如图所示.铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表).
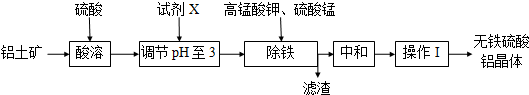
(1)试剂X可以用下列试剂中的a(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).

| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).
12.根据表提供的数据,下列判断正确的是( )
| 化学式 | 电离常数 |
| HF | Ki=3.5×10-4 |
| H2CO3 | Ki1=4.4×10-7 |
| Ki2=4.7×10-11 | |
| HClO | Ki=3.2×10-8 |
| A. | 同温同浓度下,溶液的pH:NaF>NaClO>Na2CO3 | |
| B. | 结合H+的能力:ClO-<HCO3-<F- | |
| C. | 次氯酸钠溶液中通少量二氧化碳的离子方程式:ClO-+CO2+H2O═HCO3-+HClO | |
| D. | 碳酸钠溶液中加入少量氢氟酸的离子方程式:CO32-+2HF═2F-+H2O+CO2↑ |
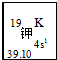 我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题: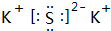 .
.