题目内容
19.下列设计的实验方案能达到实验目的是( )| A. | 制备Fe(OH)3胶体:在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液 | |
| B. | 配制pH=3的CH3COOH溶液:取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL | |
| C. | 提纯含有少量溴的溴苯:向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,静置、分液,并除去有机相的水 | |
| D. | 比较AgCl、AgI的Ksp:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中,加入1 mL 2 mol•L-1AgNO3溶液 |
分析 A.氯化铁与氢氧化钠溶液反应生成氢氧化铁沉淀,不会得到氢氧化铁胶体;
B.醋酸为弱酸,稀释后溶液中醋酸的浓度为0.01mol/L,而氢离子浓度小于0.01mol/L;
C.溴与氢氧化钠溶液反应,而溴苯不与氢氧化钠溶液反应,可以通过分液操作除去溴苯中的溴;
D.应该滴入少量的硝酸银溶液,否则无法判断二者溶度积大小.
解答 解:A.在加热时,向0.1 mol•L-1FeCl3溶液中滴加NaOH溶液,得到的是氢氧化铁沉淀,应该将饱和氯化铁溶液滴入沸水中加热制取氢氧化铁胶体,故A错误;
B.取1 mL 1 mol•L-1CH3COOH溶液加水至100 mL,稀释后醋酸的浓度为0.01mol/L,而醋酸为弱电解质,部分电离出氢离子,所以稀释后溶液中氢离子浓度小于0.01mol/L,溶液的pH>3,该方法无法达到实验目的,故B错误;
C.向含有少量溴的溴苯中加入过量NaOH溶液充分振荡后,溴单质与氢氧化钠溶液反应,而溴苯不反应,混合液分层,可通过分液操作除去溴苯中的溴,故C正确;
D.加入的硝酸银溶液过多,无法据此判断AgCl、AgI的Ksp的大小,正确的方法为:向1 mL浓度均为2 mol•L-1的Cl-、I-的混合溶液中滴加少量几滴2 mol•L-1AgNO3溶液,出现黄色沉淀,说明Ksp(AgCl)>Ksp(AgI),故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,题目难度不大,涉及物质分离与提纯、溶度积大小比较、离子检验、物质检验等知识点,明确实验原理及物质性质是解本题关键,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
10.现代生活需要人们有一定的科学素养,下列有关化学的科学常识正确的是( )
| A. | 利用SiO2的导电性来制备光导纤维 | |
| B. | 可用热的饱和碳酸钠溶液除去金属表面的矿物油 | |
| C. | “地沟油”不能食用,但可以加工成肥皂或生物柴油 | |
| D. | 发展新能源汽车的主要目的是为了减少PM2.5的排放 |
14.下列有关试剂存放或实验操作正确的是( )
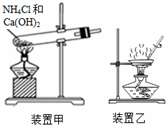

| A. | 液溴应盛放在用水密封且用玻璃塞塞紧的棕色试剂瓶中 | |
| B. | 用湿润的红色石蕊试纸检验酸性气体 | |
| C. | 用装置甲制备氨气 | |
| D. | 用装置乙加热分解Al(OH)3固体 |
8.向200mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,过滤、加热并灼烧直至质量不再变化,此时固体的质量可能为( )
| A. | 1.60 g | B. | 2.76 g | C. | 4.36 g | D. | 5.54 g |
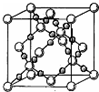 X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.
X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.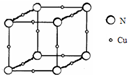 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.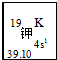 我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题:
我国的四大发明之一黑火药,爆炸时反应的化学方程式为:S+2KNO3+3C→K2S+3CO2↑+N2↑.请根据其中所含的元素回答下列问题: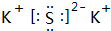 .
.