题目内容
16.将500mL4mol/LH2SO4与1000mL1mol/LNa2SO4溶液混合,混合液总体积为1500mL,则此混合液中各溶质的物质的量的浓度c(H2SO4)=$\frac{4}{3}$mol/L、c(Na2SO4)=$\frac{2}{3}$mol∥L.分析 稀释前后溶液中溶质的物质的量不变,根据稀释定律C1V1=C2V2计算.
解答 解:设混合后硫酸的物质的量浓度为c,则:
0.5L×4mol/L=c×1.5L
解得c=$\frac{4}{3}$mol/L,
混合前后硫酸钠的物质的量不变,则混合后硫酸钠的物质的量浓度为$\frac{1L×1mol/L}{1.5L}$=$\frac{2}{3}$mol/L,
故答案为:c(H2SO4)=$\frac{4}{3}$mol/L,c(Na2SO4)=$\frac{2}{3}$mol∥L.
点评 本题考查物质的量浓度有关计算,比较基础,注意对物质的量浓度公式的理解与灵活应用.

练习册系列答案
相关题目
6.向一定量的饱和石灰水中不断通入二氧化碳,其溶液质量变化是( )
| A. | 变小 | B. | 变大 | C. | 先变大后变小 | D. | 先变小后变大 |
1.将H(CB11H6Cl6)与C60反应,C60得到一个质子,制得离子化合物[HC60]+[CB11H6Cl6]-.下列反应中,反应类型与之相似的是( )
| A. | Mg+2HCl→MgCl2+H2↑ | B. | NaOH+HCl→NaCl+H2O | ||
| C. | H2O+CH3COOH?H3O++CH3COO- | D. | NH3+HCl→NH4Cl |
8.向200mL 0.1mol/L 的Fe(NO3)2溶液中加入一定量NaOH,使Fe2+完全沉淀,过滤、加热并灼烧直至质量不再变化,此时固体的质量可能为( )
| A. | 1.60 g | B. | 2.76 g | C. | 4.36 g | D. | 5.54 g |
5.无铁硫酸铝是制造高档纸张和高级织物的重要原材料,制取无铁硫酸铝的工艺流程如图所示.铝土矿酸溶后得到含铁(Fe2+和Fe3+)的硫酸铝溶液,再经过后续加工,最终得到成品无铁硫酸铝(溶液中各种金属离子开始沉淀和沉淀完全时的pH见表).
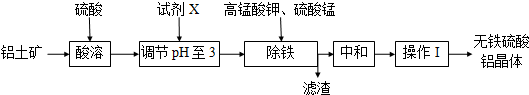
(1)试剂X可以用下列试剂中的a(填编号)
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).

| 开始 | 完全 | |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.3 | 5.0 |
| Mn2+ | 8.3 | 9.8 |
a.铝土矿粉 b.氢氧化钠 c.氧化钙
(2)生产中控制pH为3而不大于3的原因是pH超过3.3将导致Al3+沉淀,降低成品产量;
(3)操作I的名称蒸发浓缩、冷却结晶、过滤洗涤;
(4)除铁时,必须先加入高锰酸钾溶液,目的是把Fe2+转化为Fe3+;高锰酸钾溶液和硫酸锰溶液反应生成活性二氧化锰,写出反应的化学方程式2KMnO4+3MnSO4+2H2O═5MnO2↓+2H2SO4+K2SO4;
(5)滤渣的含铁成分是Fe(OH)3,用离子方程式表示其成因Fe3++3H2O?Fe(OH)3+3H+;
(6)活性二氧化锰能和Fe(OH)3发生吸附共沉作用,用化学平衡理论解释活性二氧化锰的作用吸附Fe(OH)3,促使Fe3+水解而充分沉淀(或促使水解平衡正向移动).
14.镧是重要的稀土元素,应用非常广泛,如应用于压电材料、催化剂等领域.

已知:
①镧是较活泼金属,在空气中易被氧化;
②氢氧化镧是难溶于水的弱碱;
③
(1)操作1、3是相同操作,其名称是过滤.
(2)操作2要在HCl气体的氛围内加热的原因是防止LaCl3水解.
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)真空、高温过程中的反应方程式为3Ca+2LaF3$\frac{\underline{\;真空\;}}{高温}$3CaF2+2La.
(5)粗镧精制过程中温度控制范围1487~3470℃.
(6)重熔蒸馏制得的镧中仍然混有极少量的钙.某批次产品69.709g,经分析含钙0.209g,该产品的等级为分析纯(化工产品等级标准:优级纯≥99.8%,分析纯≥99.7%,化学纯≥99.5%)

已知:
①镧是较活泼金属,在空气中易被氧化;
②氢氧化镧是难溶于水的弱碱;
③
| 金 属 | 熔点(℃) | 沸点(℃) |
| 钙 | 841 | 1 487 |
| 镧 | 920 | 3 470 |
(2)操作2要在HCl气体的氛围内加热的原因是防止LaCl3水解.
(3)电解制镧的尾气要用碱液吸收,请写出反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
(4)真空、高温过程中的反应方程式为3Ca+2LaF3$\frac{\underline{\;真空\;}}{高温}$3CaF2+2La.
(5)粗镧精制过程中温度控制范围1487~3470℃.
(6)重熔蒸馏制得的镧中仍然混有极少量的钙.某批次产品69.709g,经分析含钙0.209g,该产品的等级为分析纯(化工产品等级标准:优级纯≥99.8%,分析纯≥99.7%,化学纯≥99.5%)
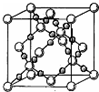 X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.
X、Y、Z、Q、R为原子序数依次增大的前四周期元素.X的一种1﹕2型氢化物分子中既有σ键又有π键,且分子中所有原子共平面;Z的L层有2个未成对电子;Q是所在周期中电负性最大的元素,QZ2可替代Q2作新的自来水消毒剂;R在周期表中位于d区,其基态原子有两个能级处于半充满状态.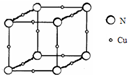 原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.
原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构.