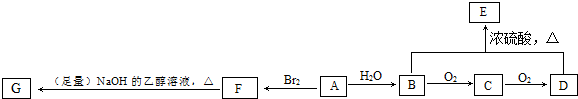
题目内容
12.以下是对重要非金属及其化合物的讨论,根据要求回答问题:(1)实验室盛装NaOH溶液的试剂瓶不能用玻璃塞,应该用橡胶塞,以防止发生反应:SiO2+2OH-═SiO32-+H2O(离子方程式);
(2)氨是一种重要的化工产品;实验室制备氨气的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)工业上制取漂白粉的化学反应方程式为2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;除去氯气中混有氯化氢的方法是将气体通入饱和氯化钠溶液中.
(4)浓H2SO4常用作气体干燥剂,是因为它具有吸水性;碳与浓硫酸反应的化学方程式为2H2SO4(浓)+C$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O.
(5)铜和稀硝酸反应的离子方程式是3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O.若参加反应的Cu质量为6.4g,则转移电子物质的量为0.2mol.
分析 (1)氢氧化钠与二氧化硅反应生成硅酸钠和水,据此写出反应的离子方程式;
(2)实验制氨气是用固体氯化铵和固体氢氧化钙反应生成氨气;
(3)工业上用氯气与氢氧化钙溶液反应制取漂白粉;除去氯气中混有氯化氢的方法是将气体通入饱和食盐水;
(4)浓硫酸具有吸水性,能够用作干燥剂;浓硫酸氧化C,同时被还原生成具有刺激性气味的二氧化硫;
(5)铜与稀硝酸反应生成硝酸铜、一氧化氮和水;根据反应方程式及铜的物质的量计算出转移的电子的物质的量.
解答 解:(1)氢氧化钠溶液能够与二氧化硅反应,反应的离子方程式为:SiO2+2OH-═SiO32-+H2O,所以盛放氢氧化钠的瓶塞不能使用玻璃塞,
故答案为:SiO2+2OH-═SiO32-+H2O;
(2)实验制氨气是用固体氯化铵和固体氢氧化钙反应生成氨气,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)氯气与氢氧化钙反应制备漂白粉,则漂白粉的主要成分为Ca(ClO)2、CaCl2,有效成分为Ca(ClO)2,工业上制取漂白粉的化学方程式为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O,除去氯气中混有氯化氢的方法是将气体通入饱和食盐水;
故答案为:2Cl2+2Ca(OH)2═Ca(ClO)2+CaCl2+2H2O;饱和氯化钠溶液;
(4)生成的具有刺激性气味的气体是二氧化硫,反应的化学方程式是:2H2SO4(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O,
故答案为:2H2SO4(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
故答案为:吸水性;2H2SO4(浓)+C $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O;
(5)向稀硝酸溶液中加入铜片,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;0.1mol铜完全反应失去0.2mol电子,故答案为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;0.2.
点评 本题考查了化学试剂的保存、氯气与漂白粉的工业制法、浓硫酸、浓硝酸的化学性质及计算,题目难度中等,试题涉及的题量较大,知识点较多,充分考查了学生对所学知识的掌握情况.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案| A. | 5mol•L-1 | B. | 2.5mol•L-1? | C. | 2.1mol•L-1 | D. | 1.27mol•L-1? |
| A. | 乙烯与乙炔 | B. | 丙烷与乙炔 | C. | 丙烯与丁烯 | D. | 乙烷与丙烷 |
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 转移溶液时不慎有少量洒到容量瓶外面 | |
| C. | 容量瓶不干燥,含有少量蒸馏水 | |
| D. | 定容时俯视刻度线 |

| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
| A. | pH=4的亚硝酸溶液c(H+)=1×10-4mol/L | |
| B. | 用亚硝酸溶液作导电实验,灯泡很暗 | |
| C. | 将Vml pH=4的亚硝酸稀释成pH=5的溶液,所需加入的水量大于10Vml | |
| D. | 10mL 1mol/L的亚硝酸恰好与10mL 1mol/L NaOH溶液完全中和 |
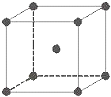 金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).
金属铁晶体为体心立方堆积(如图),实验测得铁的密度为ρ(g•cm-3).已知铁的相对原子质量为a,阿伏加德罗常数为NA(mol-1).