题目内容
7.下列实验操作错误的是( )| A. | 为防止试管破裂,加热固体碳酸氢钠时,试管口应略向下倾斜 | |
| B. | 为防止液体暴沸,蒸馏时可在烧瓶中加入少量碎瓷片 | |
| C. | 容量瓶可用于配制一定物质的量浓度的溶液,不可作为反应容器使用 | |
| D. | 配制500mL 0.1 mol/L NaOH溶液时,将2g NaOH固体倒入500mL容量瓶中,加水至凹液面与刻度线相切 |
分析 A.对试管内固体物质加热时,注意对试管的保护,防止试管炸裂;
B.为防止液体暴沸可加入沸石;
C.容量瓶不可作为反应容器使用;
D.容量瓶不能用来溶解固体.
解答 解:A.在对试管内的固体药品加热时,固体药品存放时因受潮而含有少量水或受热时生成的水会在管口液化为液体,此时如果试管口高于试管底部,水则会流向试管底(倒流),而使试管受热不均匀而炸裂,故A正确;
B.加热仪器中的液体时(如蒸馏或分馏),为防止液体暴沸可在蒸馏烧瓶中加入少量碎瓷片,故B正确;
C.配制一定物质的量浓度的溶液需要使用容量瓶,容量瓶不可作为反应容器使用,故C正确;
D.容量瓶不能用来溶解固体,应在小烧杯中溶解,故D错误.
故选D.
点评 本题考查较为综合,涉及基础实验操作,侧重于学生的分析能力和实验能力的考查,为高频考点,注意把握实验的方法、步骤和使用的仪器,注重相关基础知识的积累,难度不大.

练习册系列答案
相关题目
18.某同学按下述操作配制100 mL 0.20 mol•L-1Na2SO4溶液,请回答有关问题.
(2)取出该Na2SO4溶液10mL加水稀释到100mL,稀释后溶液中Na+的物质的量浓度是0.04mol/L.
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
| (1)实验步骤 | 有关问题 |
| ①计算所需Na2SO4的质量 | 需要称量Na2SO4的质量为3.0g |
| ②称量Na2SO4固体 | 称量需要用到的主要仪器是:托盘天平 |
| ③将Na2SO4加入100mL烧杯中,并加入适量水 | 用玻璃棒搅拌至完全溶解,冷却至室温 |
| ④将烧杯中溶液转移至仪器A中(已检查不漏水) | 仪器A是100mL容量瓶; |
| ⑤洗涤烧杯,转移,定容 | \ |
| ⑥摇匀、装瓶、贴上标签 | \ |
(3)在实验中,以下操作对实验结果没有影响的是C.
A.没有将洗涤液转移到容量瓶中 B.定容时仰视刻度线
C.转移前没有将使用的容量瓶烘干
D.定容摇匀后,发现凹液面低于刻度线,又用胶头滴管加蒸馏水至刻度线
(4)请写出检验溶液中的SO42-的具体操作:取少量待测液,滴加稀盐酸,若无明显现象,再滴加氯化钡溶液,产生白色沉淀.
15.下列各组物质的分类正确的是( )
| A. | 同位素:1H、D+、T2 | |
| B. | 电解质:CaCO3、CH3COOH、NH4HCO3 | |
| C. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 | |
| D. | 硅酸盐产品:晶体硅、水泥、陶瓷 |
2.某氯化镁溶液的密度为1.18g•cm-3,其中镁离子的质量分数为5.1%,500mL该溶液中Cl-的物质的量浓度约等于( )
| A. | 5mol•L-1 | B. | 2.5mol•L-1? | C. | 2.1mol•L-1 | D. | 1.27mol•L-1? |
12.二十世纪化学合成技术的发展对人类健康水平和生活质量的提高做出了巨大贡献.下列各组物质全部为合成高分子材料的是( )
| A. | 纤维素 涤纶 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 淀粉 聚异戊二烯 |
19.下列物质中含有少量杂质,请在空格中填上适宜的试剂或方法:
| 物质 | 杂质 | 除杂试剂或方法 |
| (1)FeCl3溶液 | FeCl2 | |
| (2)FeCl2溶液 | FeCl3 | |
| (3)FeSO4溶液 | CuSO4 | |
| (4)Na2CO3 | NaHCO3 | |
| (5)Mg (OH)2 | Al(OH)3 | , |
16.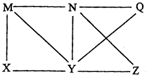 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )| A. | X可能为Al或Cl2 | B. | Y一定为NaOH(aq) | ||
| C. | N一定是HCl(aq) | D. | Q、Z中的一种必定为Al2O3 |
17.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )
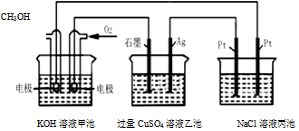

| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |