题目内容
7.下列除杂质的操作中不正确的是( )| A. | SO2中混有HCl:将其通入Na2SO3溶液 | |
| B. | NaHCO3溶液中混有少量的Na2CO3:往该溶液中通入过量的CO2气体 | |
| C. | 铁粉中混有铝粉:加入过量烧碱溶液充分反应、过滤 | |
| D. | FeCl2溶液中混有少量FeCl3:加入适量铁粉 |
分析 A.二者都与Na2SO3溶液反应;
B.碳酸钠与二氧化碳反应生成碳酸氢钠;
C.铝与氢氧化钠溶液反应;
D.氯化铁与铁粉反应生成氯化亚铁.
解答 解:A.二者都与Na2SO3溶液反应,应用饱和亚硫酸氢钠溶液除杂,故A错误;
B.碳酸钠与二氧化碳反应生成碳酸氢钠,可用于除杂,故B正确;
C.铝与氢氧化钠溶液反应,可用于除杂,故C正确;
D.氯化铁与铁粉反应生成氯化亚铁,可用于除杂,故D正确.
故选A.
点评 本题考查物质的分离、提纯,为高频考点,侧重于学生的分析能力和实验能力的考查,除杂时注意不能引入新杂质,且不能影响被提纯的物质,难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
17.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )
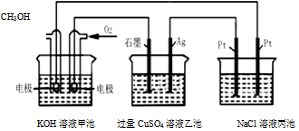

| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
15.下列关于热化学反应的描述中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 1mol甲烷燃烧生成水蒸汽和二氧化碳所放出的热量就是甲烷的燃烧热 | |
| C. | CO(g)的燃烧热△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol | |
| D. | 已知中和热△H=-57.3kJ/mol,则稀H2SO4和Ba(OH)2溶液反应生成2molH2O的反应热△H=-114.6kJ/mol |
12.Fe和Fe2O3的混合物共13.6g,加入150mL稀H2SO4,在标准状况下收集到1.12LH2,Fe和Fe2O3全部溶解,向所得溶液中加入KSCN无明显现象,为使Fe元素恰好全部转化为沉淀,消耗了200mL 3mol/L的NaOH溶液,则该H2SO4的物质的量浓度为( )
| A. | 2.25mol/L | B. | 2mol/L | C. | 4mol/L | D. | 0.6mol/L |
16.两种金属混合物共15g,投入足量的盐酸中,充分反应得11.2L H2(标准状况),则原混合物组成中肯定不能为下列的( )
| A. | Mg、Ag | B. | Fe、Zn | C. | Al、Fe | D. | Mg、Fe |