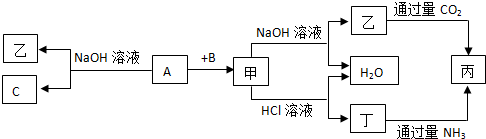
题目内容
19.以石油裂解气为原料,通过一系列化学反应可得到重要的化工产品增塑剂G.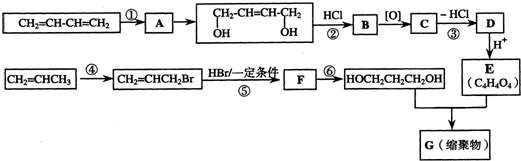
请回答下列问题:
(1)反应①化学方程式为CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CH-CH2Cl
(2)反应②③的目的是:保护碳碳双键,防止被氧化.
(3)写出反应③的化学方程式:
 .写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.
.写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.(4)写出B的结构简式.B被氧化成C的过程中会有中间产物生成,该中间产物可能是HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH(写出一种物质的结构简式),检验该物质存在的试剂是银氨溶液或新制氢氧化铜悬浊液.
(5)写出生成G的化学方程式nHOCH2CH2CH2OH+nHOOCCH=CHCOOH→2nH2O+
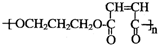 .
.
分析 1,3-丁二烯可以与氯气发生1,4-加成反应生成A为ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH=CHCH2OH,与HCl发生加成反应生成B为HOCH2CH2CH(Cl)CH2OH.D酸化得到C4H4O4,故D为盐,则C4H4O4为HOOC-CH=CH-COOH,故B发生催化氧化生成C为HOOCCH2CH(Cl)COOH,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,则D为NaOOC-CH=CH-COONa,CH3CH=CH2与溴发生取代反应生成BrCH2CH=CH2,与HBr发生加成反应生成F为BrCH2CH2CH2Br,F在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH,与HOOC-CH=CH-COOH通过酯化反应进行的缩聚反应生成高聚物G为 ,以此来解答.
,以此来解答.
解答 解:1,3-丁二烯可以与氯气发生1,4-加成反应生成A为ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH=CHCH2OH,与HCl发生加成反应生成B为HOCH2CH2CH(Cl)CH2OH.D酸化得到C4H4O4,故D为盐,则C4H4O4为HOOC-CH=CH-COOH,故B发生催化氧化生成C为HOOCCH2CH(Cl)COOH,C在氢氧化钠醇溶液、加热条件下发生消去反应生成D,则D为NaOOC-CH=CH-COONa.
CH3CH=CH2与溴发生取代反应生成BrCH2CH=CH2,与HBr发生加成反应生成F为BrCH2CH2CH2Br,F在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH,与HOOC-CH=CH-COOH通过酯化反应进行的缩聚反应生成高聚物G为 ,
,
(1)反应①为1,3-丁二烯可以与氯气发生1,4-加成反应生成ClCH2CH=CHCH2Cl,化学方程式为CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CH-CH2Cl,
故答案为:CH2=CH-CH=CH2+Cl2→CH2Cl-CH=CH-CH2Cl;
(2)HOCH2CH=CHCH2OH中含有C=C双键,氧化羟基时也可以氧化C=C双键,转化生成E为HOOCCH=CHCOOH,E中含有C=C双键,故反应②③的目的是:保护碳碳双键,防止被氧化,
故答案为:保护碳碳双键,防止被氧化;
(3)反应③是HOOCCH2CHClCOOH在氢氧化钠醇溶液、加热条件下发生消去反应生成NaOOC-CH=CH-COONa,反应方程式为 ,反应⑥是BrCH2CH2CH2Br在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH,反应方程式为CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr,
,反应⑥是BrCH2CH2CH2Br在氢氧化钠水溶液、加热条件下发生水解反应生成HOCH2CH2CH2OH,反应方程式为CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr,
故答案为: ;CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr;
;CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr;
(4)B为HOCH2CH2CH(Cl)CH2OH.B被氧化成C的过程中,可能氧化不完全会有中间产物生成,该中间产物可能是HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH,含有醛基,用银氨溶液或新制氢氧化铜悬浊液进行检验是否存在该物质,
故答案为:HOCH2CH2CH(Cl)CH2OH;HOCH2CHClCH2CHO或OHCCHClCH2CHO或OHCCHClCH2COOH;银氨溶液或新制氢氧化铜悬浊液;
(5)由上述分析可知,G的结构简式为 ,生成G的化学方程式为nHOCH2CH2CH2OH+nHOOCCH=CHCOOH→2nH2O+
,生成G的化学方程式为nHOCH2CH2CH2OH+nHOOCCH=CHCOOH→2nH2O+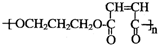 ,
,
故答案为:nHOCH2CH2CH2OH+nHOOCCH=CHCOOH→2nH2O+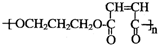 .
.
点评 本题考查有机物的推断与合成,为高频考点,全面考查有机物基础知识,把握官能团的性质与转化是关键,有机框图题的解答要充分利用题给信息,通过对比反应前后物质结构上的差异推断反应原理,对学生的逻辑推理有一定的要求,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 葡萄糖 | B. | 氨基乙酸 | C. | 淀粉 | D. | 碳酸钠 |
①用氨水清洗做过银镜反应的试管
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸.
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
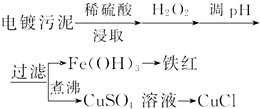
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.3 | 7.6 | 4.4 |
| 完全沉淀的pH | 3.2 | 9.7 | 6.4 |
(2)煮沸CuSO4溶液的原因是除净溶液中的H2O2,避免影响下一步CuCl的生成.
向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式2CuSO4+2NaCl+Na2SO3+H2O=2CuCl↓+2Na2SO4+H2SO4.
(3)Fe3+发生水解反应Fe3++3H2O?Fe(OH)3+3H+,该反应的平衡常数表达式为K=$\frac{c{\;}^{3}(H{\;}^{+})}{c(Fe{\;}^{3+})}$.
(4)称取所制备的CuCl样品0.250 0g置于一定量的0.5mol•L-1FeCl3溶液中,待样品完全溶解后,加水20mL,用0.100 0mol•L-1的Ce(SO4)2溶液滴定,到达终点时消耗Ce(SO4)2溶液25.00mL.有关的化学反应为Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+.计算该CuCl样品的质量分数99.50%.
| A. | 12g的金刚石晶体中含有碳碳键的数目为4NA | |
| B. | 4g氦气含有的原子总数为NA | |
| C. | 石墨中C和C-C键的比为2:3 | |
| D. | 60gSiO2含有Si-O键的个数为2NA |
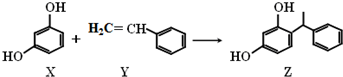
| A. | X、Y和Z均能与溴水发生反应,其中X、Z发生取代反应,Y发生加成反应 | |
| B. | X和Z均能NaOH溶液反应,也能与NaHCO3溶液反应放出CO2 | |
| C. | Y既能与H2发生加成反应,也能使酸性高锰酸钾溶液褪色 | |
| D. | Y可作加聚反应单体,X可作缩聚反应单体 |

在催化剂存在下,由苯和以下各组物质合成乙苯最好应选用的是( )
| A. | CH3CH3和Cl2 | B. | CH2=CH2和HCl | C. | CH2=CH2和Cl2 | D. | CH3CH3和HCl |