题目内容
7.下列是有关实验的叙述中,合理的是( )①用氨水清洗做过银镜反应的试管
②不宜用瓷坩埚灼烧氢氧化钠固体
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤后烘干
④用酸式滴定管量取12.00mL高锰酸钾溶液
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH都偏小
⑥配制FeSO4溶液时,需加入少量铁粉和稀硫酸.
| A. | ②④⑥ | B. | ②③⑥ | C. | ①②④ | D. | ②③④⑤⑥ |
分析 ①用稀硝酸清洗做过银镜反应的试管;
②熔融状态下,二氧化硅和NaOH反应生成硅酸钠;
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤,但不需要烘干;
④酸式滴定管只能量取酸性溶液;
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH不一定偏小,也可能不变;
⑥FeSO4中亚铁离子易被空气氧化生成铁离子,且也易发生水解反应.
解答 解:①Ag和氨水不反应,但能和稀硝酸反应生成可溶性的硝酸银溶液,所以用稀硝酸清洗做过银镜反应的试管,故错误;
②瓷器中含有二氧化硅,熔融状态下,二氧化硅和NaOH反应生成硅酸钠,所以不能用瓷坩埚灼烧氢氧化钠固体,应该用铁坩埚,故正确;
③使用容量瓶的第一步操作是先将容量瓶用蒸馏水洗涤,但不需要烘干,因为在配制溶液过程中也需要加入水,如果有少量水不影响溶液配制,故错误;
④酸式滴定管只能量取酸性溶液,酸性高锰酸钾溶液呈酸性,所以只能用酸式滴定管量取,故正确;
⑤使用pH试纸测定溶液pH时先润湿,测得溶液的pH不一定偏小,也可能不变,如强酸强碱盐溶液呈中性,与其浓度大小无关,故错误;
⑥FeSO4中亚铁离子易被空气氧化生成铁离子,且也易发生水解反应,为了防止硫酸亚铁被氧化和水解,所以在配制硫酸亚铁溶液时需要加入少量铁粉和稀硫酸,故正确;
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及盐类水解、仪器使用、仪器洗涤等知识点,明确实验原理、物质性质、实验基本操作方法是解本题关键,熟练掌握常见元素化合物性质,易错选项是⑤.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
17.将 E 和 F 加入密闭容器中,在一定条件下发生反应:2E(g)+F(s)?G(g).忽略固体体积,平衡时 E的体积分数(%)随温度和压强的变化如下表所示.下列推断不正确的是( )
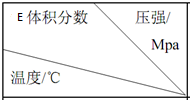 | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A. | 915℃,2.0 MPa 时 E 的转化率为 60% | |
| B. | K(810℃)>K(1000℃) | |
| C. | 该反应可在较低温度下自发进行 | |
| D. | e>d |
15.有关合金的说法不正确的是( )
| A. | 合金的熔点比它的各成分金属的熔点低 | |
| B. | 合金一定是金属熔合而成的物质 | |
| C. | 合金的硬度和强度一般比纯金属大 | |
| D. | 硬铝、黄铜、钢等均为合金 |
2.下列分子中,所有原子最外层均为 8 电子结构的是( )
| A. | CO2 | B. | BF3 | C. | LiCl | D. | NH3 |
12.下列实验设计能够成功的是( )
| A. | 检验试液中的SO42-:试液$\stackrel{足量稀硝酸}{→}$无沉淀$\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液}{→}$$\stackrel{振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr3: |
3.火法炼汞是在不太高的温度下(450~800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:
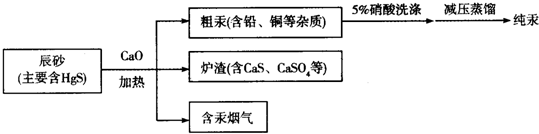
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 流程中加入氧化钙的目的是减少SO2的排放 | |
| B. | “辰砂”加热时发生反应:HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2,该方法属于热分解法 | |
| C. | 洗涤粗汞时可用5%的盐酸代替5%的硝酸 | |
| D. | 含汞烟气中汞的含量很低,可以直接排放 |
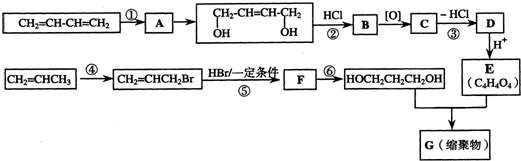
 .写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.
.写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.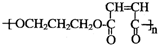 .
.