题目内容
4.用NA表示阿伏加德罗常数,下列叙述中正确的是( )| A. | 12g的金刚石晶体中含有碳碳键的数目为4NA | |
| B. | 4g氦气含有的原子总数为NA | |
| C. | 石墨中C和C-C键的比为2:3 | |
| D. | 60gSiO2含有Si-O键的个数为2NA |
分析 A、求出金刚石的物质的量,然后根据1mol金刚石中含2mol碳碳键来分析;
B、氦气由氦原子构成;
C、石墨中1个碳原子形成1.5条C-C键;
D、求出二氧化硅的物质的量,然后根据1mol二氧化硅中含4mol硅氧键来分析.
解答 解:A、12g金刚石的物质的量为1mol,而1mol金刚石中含2mol碳碳键,故含2NA个,故A错误;
B、氦气由氦原子构成,故4g氦气中含有的氦原子的物质的量为1mol,个数为NA个,故B正确;
C、石墨中1个碳原子形成1.5条C-C键,故碳原子和C-C键的个数之比为2:3,故C正确;
D、60g二氧化硅的物质的量为1mol,而1mol二氧化硅中含4mol硅氧键,故含4NA条,故D错误.
故选BC.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
14.下表列出了十种元素在周期表中的位置,用化学用语回答下列问题:
请回答:
(1)在这些元素中,化学性质最不活泼的是Ar(填元素符号).与其具有相同的电子层结构的是表中②和⑨的简单离子,它们的离子结构示意图为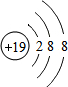 、
、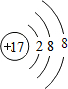 .
.
(2)形成化合物种类最多的元素是C(填元素符号),其稳定氧化物的结构式为O=C=O.
(3)⑤、⑥、⑦、⑧四种元素所对应的气态氢化物最稳定的是H2O(填化学式).
(4)以上第三周期元素中的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式),二者发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)①、②、③的原子半径由大到小的顺序为K>Na>Mg(填元素符号).
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
(1)在这些元素中,化学性质最不活泼的是Ar(填元素符号).与其具有相同的电子层结构的是表中②和⑨的简单离子,它们的离子结构示意图为
 、
、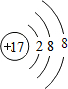 .
.(2)形成化合物种类最多的元素是C(填元素符号),其稳定氧化物的结构式为O=C=O.
(3)⑤、⑥、⑦、⑧四种元素所对应的气态氢化物最稳定的是H2O(填化学式).
(4)以上第三周期元素中的最高价氧化物对应的水化物中,碱性最强的是NaOH(填化学式),呈两性的是Al(OH)3(填化学式),二者发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
(5)①、②、③的原子半径由大到小的顺序为K>Na>Mg(填元素符号).
15.有关合金的说法不正确的是( )
| A. | 合金的熔点比它的各成分金属的熔点低 | |
| B. | 合金一定是金属熔合而成的物质 | |
| C. | 合金的硬度和强度一般比纯金属大 | |
| D. | 硬铝、黄铜、钢等均为合金 |
12.下列实验设计能够成功的是( )
| A. | 检验试液中的SO42-:试液$\stackrel{足量稀硝酸}{→}$无沉淀$\stackrel{BaCl_{2}溶液}{→}$白色沉淀 | |
| B. | 除去乙酸乙酯中混有的乙酸:混合液$\stackrel{饱和碳酸钠溶液}{→}$$\stackrel{振荡}{→}$溶液分层$\stackrel{分液}{→}$得上层液体 | |
| C. | 证明酸性条件下H2O2氧化性比I2强:NaI溶液$\stackrel{30%H_{2}O_{2}溶液}{→}$$\stackrel{稀硝酸及淀粉}{→}$溶液变蓝色 | |
| D. | 鉴定盐A的成分是FeBr3: |
3.火法炼汞是在不太高的温度下(450~800℃),将汞矿石或精矿进行焙烧,直接将汞还原呈气态分离出来,而后冷凝成液态汞.目前工业上制粗汞的流程如图:
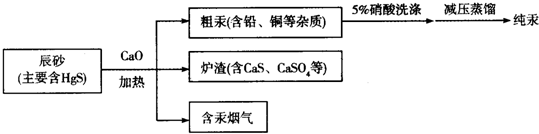
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | 流程中加入氧化钙的目的是减少SO2的排放 | |
| B. | “辰砂”加热时发生反应:HgS+O2$\frac{\underline{\;\;△\;\;}}{\;}$Hg+SO2,该方法属于热分解法 | |
| C. | 洗涤粗汞时可用5%的盐酸代替5%的硝酸 | |
| D. | 含汞烟气中汞的含量很低,可以直接排放 |
1.下列有机物中不溶于水且比水轻的是( )
| A. | 氯仿 | B. | 乙酸 | C. | 苯 | D. | 溴苯 |
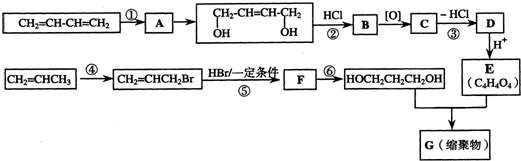
 .写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.
.写出反应⑥的化学方程式:CH2BrCH2CH2Br+2NaOH$→_{△}^{水}$HOCH2CH2CH2OH+2NaBr.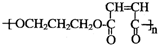 .
.