题目内容
2.(1)刘安《淮南万毕术》中“曾青得铁则化为铜”是古代湿法炼铜的真实写照.除去CuSO4溶液中少量的Fe2+,可以按照下面的流程进行: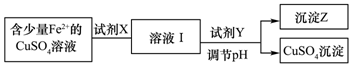
已知:Fe2+、Cu2+、Fe3+三种离子开始沉淀和完全沉淀时溶液pH值如表:
| 金属 离子 | pH | |
| 开始沉淀 | 完全沉淀 | |
| Fe2+ | 7.6 | 9.6 |
| Cu2+ | 4.4 | 6.4 |
| Fe3+ | 2.7 | 3.7 |
A.H2O2 B.KMnO4C.HNO3 D.Cl2
②加入的Y及调节的pH范围是A
A.Cu(OH)2 3.7~4.3 B.CuO 3.7~6.4
C. NaOH 3.7~4.2 D.NH3•H2O 3.7~4.0
(2)已知常温下,KspCu(OH)2]=2×10-20,通过上述流程得到的CuSO4溶液中,c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH大于5.
分析 (1)除去CuSO4溶液中少量的Fe2+,由表中数据可知,Fe3+易生成沉淀,可先加入氧化剂生成Fe3+,然后在加入Cu(OH)2、CuO等调节溶液的pH,生成氢氧化铁沉淀,过滤得到硫酸铜溶液;
(2)根据KspCu(OH)2]=c(Cu2+)×c(OH-),计算c(OH-),进而计算pH.
解答 解:(1)除去CuSO4溶液中少量的Fe2+,由表中数据可知,Fe3+易生成沉淀,可先加入氧化剂生成Fe3+,然后在加入Cu(OH)2、CuO等调节溶液的pH,生成氢氧化铁沉淀,过滤得到硫酸铜溶液,
①加入氧化剂,将Fe2+氧化生成Fe3+,为避免引入杂质,可加入H2O2,故答案为:A;
②加入Cu(OH)2、CuO等调节溶液的pH,由表中数据可知,调节pH范围为3.7~4.3,可保证氢氧化铁完全沉淀,且不生成氢氧化铜沉淀,故答案为:A;
(2)KspCu(OH)2]=c(Cu2+)×c(OH-)=2×10-20,c(Cu2+)=0.02mol/L,则c(OH-)=$\sqrt{\frac{2×1{0}^{-20}}{0.02}}$mol/L=10-9mol/L,则c(H+)=10-5mol/L,pH=5,
故答案为:5.
点评 本题考查较为综合,涉及物质的分离、提纯以及难溶电解质的溶解平衡,侧重考查学生的分析、实验和计算能力,注意把握题给信息以及物质的性质,把握相关计算公式的运用,难度不大.

练习册系列答案
 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案
相关题目
13.下列电子转移的表示正确的是( )
| A. | 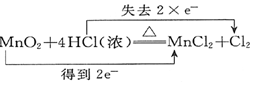 ↑+2H2O ↑+2H2O | B. | 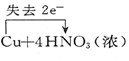 (浓)═Cu(NO3)2+2NO2↑+2H2O (浓)═Cu(NO3)2+2NO2↑+2H2O | ||
| C. | 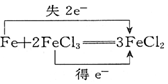 | D. | 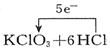 ═KCl+3Cl2↑+3H2O ═KCl+3Cl2↑+3H2O |
10.下列说法正确的是( )
| A. | 向K2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原K2CO3的物质的量之比为1:2 | |
| B. | 为处理锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加入盐酸溶解 | |
| C. | 向明矾溶液里滴加氢氧化钡溶液,当硫酸根离子恰好沉淀完全时,铝元素的存在形式是一部分为Al(OH)3沉淀,一部分以A1O2-形式存在于溶液中 | |
| D. | 加入A1放出H2的溶液中可能大量存在Fe3十、K十、C1一、NO3- |
17.实验室中需要配制2mol/L的NaCl溶液480mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A. | 480mL 56.2g | B. | 500mL 58.5g | ||
| C. | 1000mL 58.5g | D. | 任意规格 56.2g |
7.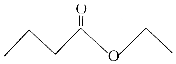 茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )
茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )
 茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )
茅台酒中存在少量具有凤梨香味的物质X,其结构如图所示,下列说法正确的是( )| A. | X难溶于乙醇 | |
| B. | X的分子式为C6H10O2 | |
| C. | 酒中的少量丁酸能抑制X的水解 | |
| D. | 分子式为C4H8O2且官能团与X相同的物质共有5种(不考虑立体结构) |
7.某同学做同主族元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:①试管;②胶头滴管(请填写一件主要的玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容:(在下列空格内填写相关内容)
(4)实验结论:同一主族,自上而下,元素原子得电子能力依次减弱.
(5)请用原子结构理论简单说明上述结论的原因:同一主族,自上而下,元素原子的核外电子层数增多,原子半径增大,核对外层电子的引力逐渐减弱,得电子能力逐渐减弱.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:①试管;②胶头滴管(请填写一件主要的玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容:(在下列空格内填写相关内容)
| 序号 | 实验方案 | 实验现象 | 化学方程式 |
| ① | 将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为橙红色 | Cl2+2NaBr=2NaCl+Br2 |
| ② | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为紫红色 |
(5)请用原子结构理论简单说明上述结论的原因:同一主族,自上而下,元素原子的核外电子层数增多,原子半径增大,核对外层电子的引力逐渐减弱,得电子能力逐渐减弱.
4.已知:有机物A可发生如图所示转化关系,且E能发生银镜反应,C不能发生银镜反应,则A的结构可能有(不考虑立体结构)( )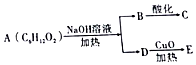

| A. | 13种 | B. | 9种 | C. | 8种 | D. | 10种 |
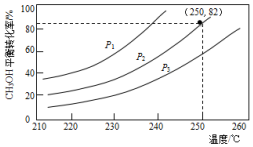 2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.
2016年9月.“乔歌里1号”中国首台静默移动发电站MFC30正式问世,MFC30是基于甲醇重整制氢燃料电池发电技术.