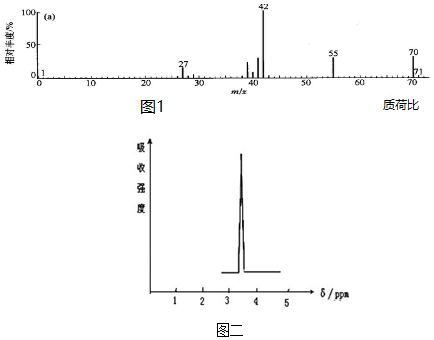
题目内容
4.设NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下NA个SO3的体积为22.4 L | |
| B. | 1 mol Fe与足量的HCl反应,转移的电子数为3NA | |
| C. | 3 mol单质Fe完全转变为Fe3O4,失去8NA个电子 | |
| D. | 标准状况下,22.4 L的CCl4中含有的CCl4分子数为NA |
分析 A.标准状况下SO3不是气体;
B.Fe与盐酸反应变为Fe2+;
C.3Fe→Fe3O4,3个Fe失去8个电子;
D.标准状况下,CCl4不是气体.
解答 解:A.NA个SO3的物质的量是1mol,但标准状况下SO3不是气体,因此其体积不是22.4 L,故A错误;
B.Fe与盐酸反应变为Fe2+,因此1 mol Fe与足量的HCl反应,转移的电子数为2NA,故B错误;
C.3Fe→Fe3O4,3个Fe失去8个电子,则3molFe失去8NA个电子,故C正确;
D.标准状况下,CCl4不是气体,不能带入n=$\frac{V}{{V}_{m}}$计算其物质的量,故D错误;
故选C.
点评 本题考查阿伏伽德罗常数的计算,为高频考点,题目难度中等,掌握转移电子数的计算方法、n=$\frac{V}{{V}_{m}}$的使用条件是解题的关键.

练习册系列答案
相关题目
14.下列关于合金的说法不正确的是( )
| A. | 合金只能由金属熔合而成 | |
| B. | 硬铝、黄铜、生铁均属于合金 | |
| C. | 焊锡(锡铅合金)熔点比金属锡低 | |
| D. | 合金的硬度可以大于它的纯金属成分 |
19.NA为阿伏伽德罗常数,下列说法正确的是( )
| A. | 标准状况下,44.8 LH2O含有的水分子数为2NA | |
| B. | 88gC02含有的C02分子数为2NA | |
| C. | 46gNO2气体含有的氧原子数为NA | |
| D. | 1mol的任何气体中都含有NA个原子 |
16.常温下,在溶液中可以发生反应:X+2Y3+═2Y2++X2+,对下列叙述的判断正确的是( )
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强.
①X被氧化 ②X是氧化剂 ③X具有还原性 ④Y2+是氧化产物 ⑤Y2+具有还原性 ⑥Y3+的氧化性比X2+的氧化性强.
| A. | ②③④⑥ | B. | ①③④⑤ | C. | ①③⑤⑥ | D. | ①②⑤⑥ |
13.下列电子转移的表示正确的是( )
| A. |  ↑+2H2O ↑+2H2O | B. | 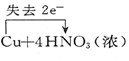 (浓)═Cu(NO3)2+2NO2↑+2H2O (浓)═Cu(NO3)2+2NO2↑+2H2O | ||
| C. | 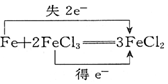 | D. | 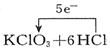 ═KCl+3Cl2↑+3H2O ═KCl+3Cl2↑+3H2O |
7.某同学做同主族元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象.现在请你帮助该学生整理并完成实验报告.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:①试管;②胶头滴管(请填写一件主要的玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容:(在下列空格内填写相关内容)
(4)实验结论:同一主族,自上而下,元素原子得电子能力依次减弱.
(5)请用原子结构理论简单说明上述结论的原因:同一主族,自上而下,元素原子的核外电子层数增多,原子半径增大,核对外层电子的引力逐渐减弱,得电子能力逐渐减弱.
(1)实验目的:探究同一主族元素性质的递变规律.
(2)实验用品:
仪器:①试管;②胶头滴管(请填写一件主要的玻璃仪器).
药品:氯水、溴水、溴化钠溶液、碘化钾溶液、四氯化碳.
(3)实验内容:(在下列空格内填写相关内容)
| 序号 | 实验方案 | 实验现象 | 化学方程式 |
| ① | 将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为橙红色 | Cl2+2NaBr=2NaCl+Br2 |
| ② | 将少量溴水加入盛有碘化钾溶液的试管中,用力振荡后加入少量四氯化碳溶液,振荡、静置 | 加入溴水后,溶液由无色变为褐色,滴入四氯化碳后,水层颜色变浅,四氯化碳层变为紫红色 |
(5)请用原子结构理论简单说明上述结论的原因:同一主族,自上而下,元素原子的核外电子层数增多,原子半径增大,核对外层电子的引力逐渐减弱,得电子能力逐渐减弱.
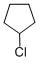 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$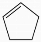 +NaCl+H2O.
+NaCl+H2O.