题目内容
7.为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图: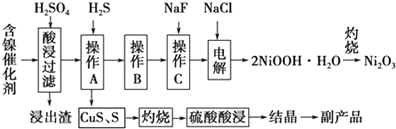
已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
分析 废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),用硫酸浸取,过滤得含有镍离子、铁离子、钙离子、铜离子的溶液,再通入硫化氢除去铜离子,且使铁离子被还原成亚铁离子,得硫化铜、硫固体,过滤得滤液中含有镍离子、亚铁离子、钙离子,加入氟化钠除去钙离子,再加入氯化钠后电解得NiOOH,灼烧得三氧化二镍,硫化铜、硫固体灼烧后用硫酸酸浸得硫酸铜溶液,结晶可得硫酸铜晶体,
(1)Fe2O3和硫酸反应生成盐和水,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)氧化钙和氧化钡与硫酸反应生成难溶的硫酸钙和硫酸钡;
(3)用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾;根据3Cu~2NO,3Cu2O~2NO,n(Cu)=0.1mol,n(NO)=0.1mol,可得混合物中Cu2O为0.05mol,故CuO为0.05mol.混合物中,0.1mol Cu不与稀H2SO4反应,0.05molCu2O、0.05molCuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4反应结合H+生成H2O,据此计算消耗硫酸;
(5)常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol•L-1,再计算出钙离子的浓度;
(6)①阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子.
解答 解:(1)Fe2O3和硫酸反应生成盐和水,反应方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,
故答案为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)氧化钙和氧化钡与硫酸反应生成难溶的硫酸钙和硫酸钡,所以浸出渣主要成分为CaSO4•2H2O和BaSO4,
故答案为:BaSO4;
(3)由于用氢氧化钠溶液调节溶液的pH值,容易引入杂质,所以方案是错误的;正确的操作应该是在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+,
故答案为:方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+;
(4)由于CuS、S灼烧后溶于稀硫酸中生成硫酸铜,所以副产品应该是胆矾,即CuSO4•5H2O,
根据3Cu~2NO可知,0.1molCu反应生成NO为$\frac{0.2}{3}$mol,故3Cu2O~2NO反应生成NO为($\frac{2.24L}{22.4L/mol}$-$\frac{0.2}{3}$mol),可得混合物中Cu2O为(0.1mol-$\frac{0.2}{3}$mol)×$\frac{3}{2}$=0.05mol,故CuO为0.25mol-0.1mol-0.05mol=0.05mol,混合物中,0.1mol Cu不与稀H2SO4反应,0.05molCu2O、0.05molCuO与稀H2SO4反应,根据Cu2O、CuO中氧原子与H2SO4反应结合H+生成H2O,可得n(H2SO4)=0.05mol+0.05mol=0.1mol,
故答案为:CuSO4•5H2O;0.1;
(5)根据常温时CaF2的溶度积常数为2.7×10-11可知,溶液中F-浓度为3×10-3 mol•L-1,则Ca2+的浓度为$\frac{2.7×10{\;}^{-11}}{(3×10{\;}^{-3}){\;}^{2}}$=3×10-6 mol/L,所以则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=$\frac{3×10{\;}^{-6}}{3×10{\;}^{-3}}$=1.0×10-3,故答案为:1.0×10-3;
(6)①阳极上氯离子失电子生成氯气,氯气和氢氧根离子反应生成次氯酸根离子和水,所以阳极反应式为Cl-+2OH--2e-═ClO-+H2O,故答案为:Cl-+2OH--2e-=ClO-+H2O;
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀,其还原产物是氯离子,则根据电子的得失守恒可知,反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-,
故答案为:ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
点评 该题以废旧含镍催化剂生产NiO为载体,重点考查学生对工艺流程试题了解掌握情况,侧重考查学生的逻辑推理能力和规范严谨的实验设计能力以及动手操作能力,该类试题综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论,题目难度中等.

| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 含有相同官能团,且相对分子量相差14的有机物一定互为同系物 | |
| D. | 互为同系物的有机物,其化学性质相似 |
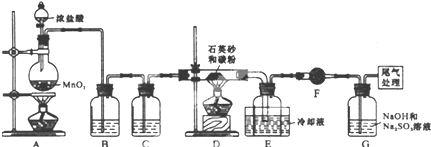
已知:SiCl4熔点为-70.0℃,沸点为57.7℃,且遇水易水解.
(1)装置C中的试剂是浓硫酸:装置F的作用为防止F右端的水蒸气进入E与四氯化硅反应,造成产物不纯.
(2)装置A中发生反应的离子方程式为:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑.A装置中,有一处明显错误是无石棉网.
(3)装置D的硬质玻璃管中发生反应的化学方程式是SiO2+2C+2Cl2$\frac{\underline{\;\;△\;\;}}{\;}$SiCl4+2CO.
(4)G中吸收气体一段时间后,吸收液中肯定存在OH-、Cl-和SO42-.为探究该吸收液中可能存在的其它酸根离子(忽略空气中CO2的影响).
【提出假设】假设1:只有SO32-;假设2:既无SO32-也无ClO-:假设3:只有ClO-.
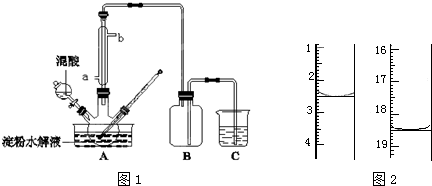
【设计方案,进行实验】可供选择的实验试剂有:3mol/L H2SO4溶液、1mol/L NaOH溶液、溴水、品红溶液、0.01mol/L KMnO4溶液、淀粉-KI溶液.
各取少量吸收液于a、b、c三支试管中,分别滴加适量的3mol/LH2SO4溶液后,进行下列实验.请完成下表:
| 序号 | 操作 | 可能出现的现象 | 结论 |
| ① | 向a试管中滴加几滴0.01mol/L的KMnO4(或溴水)溶液 | 若溶液褪色 | 则假设1成立 |
| 若溶液不褪色 | 则假设2或3成立 | ||
| ② | 向b试管中滴加几滴品红溶液 | 若溶液褪色 | 则假设1或3成立 |
| 若溶液不褪色 | 假设2成立 | ||
| ③ | 向C试管中滴加几滴淀粉-KI溶液 | 若溶液变为蓝色 | 假设3成立 |
| A. | 要使AlCl3溶液中Al3+全部沉淀出来可使用氨水 | |
| B. | 要检验某溶液中是否含Fe3+可加入铁粉 | |
| C. | 新制的氯水中可用PH试纸准确测定其PH值 | |
| D. | 某气体能使品红溶液褪色,该气体一定为SO2 |
| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
| A. | 生活中常用热的小苏打去污,利用了水解吸热的特点 | |
| B. | Mg可由电解MgCl2水溶液制取,Al可由电解熔融Al2O3制取 | |
| C. | 少数商贩在蔬菜表面洒少许福尔马林,可延长保鲜时间 | |
| D. | SiO2可用来制作光导纤维,但SiO2本身不导电 |
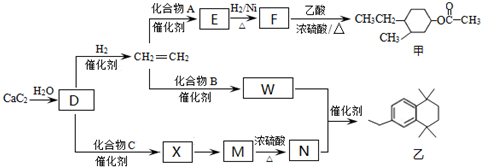
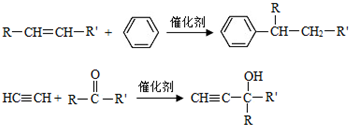 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)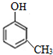 ,“E→F”的反应类型为加成反应.
,“E→F”的反应类型为加成反应.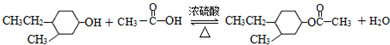 .
.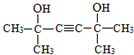 .
.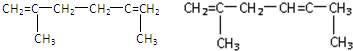 .
.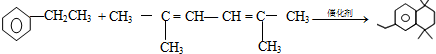 .
.