题目内容
12.设NA为阿伏加德罗常数的值,N表示粒子数.下列说法正确的是( )| A. | 0.1 mol的CaO2含阴阳离子总数是0.3NA | |
| B. | 0.1 mol苯乙烯含π键的数目为0.4NA | |
| C. | 1 L 1mol/L的Na2CO3溶液中含阴阳离子数小于3NA | |
| D. | 2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
分析 A.1mol中CaO2含有1mol钙离子和1mol过氧根离子;
B.苯环中含有1个大π键,碳碳双键中含有1个π键;
C.碳酸根离子水解生成氢氧根离子和碳酸氢根离子,导致离子总数增加;
D.钠为+1价金属,2.3g钠的物质的量为0.1mol,根据电子守恒可知0.1mol钠完全反应转移了0.1mol电子.
解答 解:A.0.1 mol的CaO2含0.1mol钙离子和0.1mol过氧根离子,总共含有0.2mol离子,含有的阴阳离子总数是0.2NA,故A错误;
B.0.1 mol苯乙烯含0.1mol大π键和0.1molπ键,含有π键的总数目0.2NA,故B错误;
C.1 L 1mol/L的Na2CO3溶液中含有1mol碳酸钠,由于碳酸根离子部分水解生成碳酸氢根离子和氢氧根离子,导致离子总数增加,所以溶液中含阴阳离子数大于3NA,故C错误;
D.2.3g钠的物质的量为:$\frac{2.3g}{23g/mol}$=0.1mol,0.1mol钠与氧气完全反应,无论生成氧化钠还是过氧化钠,转移的电子都是0.1mol,转移电子数均为0.1NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意熟练掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
2.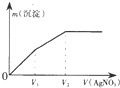 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )| A. | $\frac{{V}_{2}-{V}_{1}}{{V}_{1}}$ | B. | $\frac{{V}_{1}}{{V}_{2}}$ | C. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
3.下列有关生产生活中的化学,说法正确的是( )
| A. | Fe、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| D. | 工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |
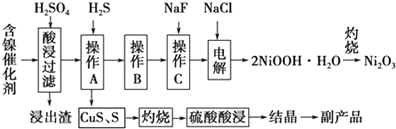
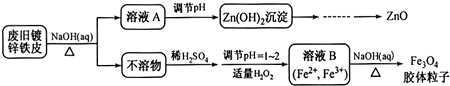
7.为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.

已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
17.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压.高铁电池的总反应为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述错误的是( )
| A. | 放电时正极附近溶液的碱性增强 | |
| B. | 充电时锌极与外电源正极相连 | |
| C. | 放电时每转移3 mol电子,正极有1mol K2FeO4被还原 | |
| D. | 充电时阳极反应为:Fe(OH)3-3e-+5OH-═FeO42-+4 H2O |
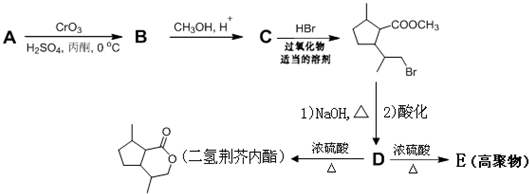
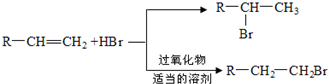
 ,D中含有的官能团的名称羧基、羟基.
,D中含有的官能团的名称羧基、羟基.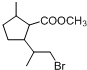 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$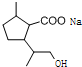 +CH3OH+NaBr.
+CH3OH+NaBr.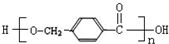 )的路线补全完整
)的路线补全完整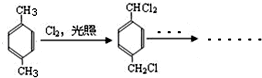
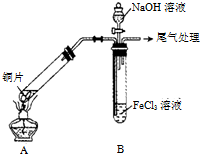 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).