题目内容
17.有机化合物甲、乙用于制备化妆品,二者合成路线如下(部分产物及条件略)
已知:
 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)问题:
(1)由D合成导电高分子物质的化学名称是聚乙炔.
(2)化合物A的结构简式为
 ,“E→F”的反应类型为加成反应.
,“E→F”的反应类型为加成反应.(3)F→有机化合物甲的化学方程式为
 .
.(4)化合物W的相对分子质量为106,B与W可用酸性KMnO4溶液进行鉴别.
(5)化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,且M、N中均只含一种官能团,N中含有四个甲基.
①X的结构简式是
 .
.②满足合成路线的N的同分异构体是
 .
.③写出N+W→乙的化学方程式
 .
.
分析 碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为 ,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为
,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为 ,E为
,E为 .化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为
.化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为 ,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为
,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为 ,则B为
,则B为 ,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为
,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为 ,X与氢气发生加成反应生成M为
,X与氢气发生加成反应生成M为 ,M发生消去反应得到N,据此答题.
,M发生消去反应得到N,据此答题.
解答 解:碳化钙与水反应生成A为CH≡CH,乙炔与氢气发生加成反应生成乙烯,由甲的结构,逆推可知F为 ,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为
,乙烯与A反应得到E,E与氢气发生加成反应生成F,化合物A能与浓溴水反应产生白色沉淀,则A为 ,E为
,E为 .化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为
.化合物C的分子式为C3H6O,核磁共振氢谱显示只有一种化学环境的氢,则C为 ,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为
,W与N发生信息中的加成反应生成乙,化合物W的相对分子质量为106,M、N中均只含一种官能团,N中含有四个甲基,结合乙的结构简式,可知W为 ,则B为
,则B为 ,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为
,N为(CH3)2C=CH-CH=C(CH3)2,故2分子丙酮与乙炔发生加成反应生成X为 ,X与氢气发生加成反应生成M为
,X与氢气发生加成反应生成M为 ,M发生消去反应得到N.
,M发生消去反应得到N.
(1)D的结构简式是CH≡CH,由D合成导电高分子物质的化学名称是聚乙炔,
故答案为:聚乙炔;
(2)根据上面的分析可知,A为 ,“E→F”的反应类型是:加成反应,
,“E→F”的反应类型是:加成反应,
故答案为: ;加成反应;
;加成反应;
(3)“F→有机化合物甲”的化学方程式是: ,
,
故答案为: ;
;
(4)W为 ,B为
,B为 ,乙苯能使酸性KMnO4溶液褪色,而苯不能,所以可以用酸性KMnO4溶液鉴别它们,
,乙苯能使酸性KMnO4溶液褪色,而苯不能,所以可以用酸性KMnO4溶液鉴别它们,
故答案为:酸性KMnO4溶液;
(5)①由上述分析可知,X的结构简式是: ,故答案为:
,故答案为: ;
;
②满足合成路线的N的同分异构体是 ,
,
故答案为: .
.
③N+W→乙的化学方程式为 ,
,
故答案为: .
.
点评 本题考查有机物的推断与合成,根据甲与乙的结构、结合问题中物质的结构特点进行推断,注意对给予的反应信息的理解,侧重考查学生分析推理能力.

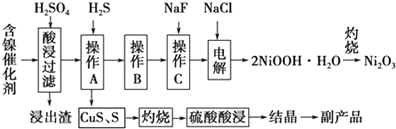
已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
| A. | KClO3(MnO2,加热) | B. | KMnO4(加热) | C. | H2O2(MnO2) | D. | HgO(加热) |
| A. | 作净水剂的明矾和作消毒剂的漂白粉都是强电解质 | |
| B. | 浸泡过高锰酸钾溶液的硅藻土放于新鲜的水果箱内是为了催熟水果 | |
| C. | 药皂中含有苯酚,能杀菌消毒,故苯酚具有强氧化性 | |
| D. | 合成氨生产中将NH3液化分离,虽可提高N2、H2的转化率但减小了反应速率 |
| A. | 3mol NO2与足量H2O反应,转移的电子数为NA | |
| B. | 在0℃,101kPa时,22.4 L氢气中含有NA个氢原子 | |
| C. | 25℃,1.01×105Pa,64g SO2中含有的原子数为3 NA | |
| D. | NA个一氧化碳分子和0.5 mol甲烷的质量比为7:4 |
| A. | 通过测定沸点区别生物柴油和矿物柴油 | |
| B. | 用水区别乙酸、溴苯和硝基苯 | |
| C. | 用溴水区别环己烷、甲苯和环己烯 | |
| D. | 用燃烧法区别乙醇、苯和四氯化碳 |
| A. | ①④⑤⑧ | B. | ②⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
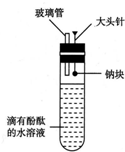 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: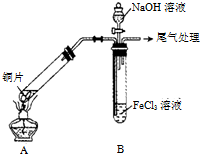 某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如图所示(夹持仪器已略去).