题目内容
20.短周期元素R、X、Y、W的部分信息如表所示:| 元素代号 | R | X | Y | W |
| 原子半径/nm | 0.077 | 0.074 | 0.186 | 0.099 |
| 主要化合价 | +4、-4 | -2 | +1 | +7、-1 |
| A. | 简单的离子半径由小到大排序:Y、X、W | |
| B. | X的气态氢化物的稳定性一定比R的强 | |
| C. | R、X和Y可以组成含共价键的离子化合物 | |
| D. | 在R、X、W的氢化物中,X的沸点最高 |
分析 短周期元素R、X、Y、W,W的主要化合价为+7、-1,则W为Cl元素;Y的主要化合价为+1,位于ⅠA族,其原子半径大于W(Cl),则Y为Na;X的主要化合价为-2,没有正化合价,则X为O元素;R的主要化合价为+4、-4,位于ⅣA族,原子半径大于O、小于Na,则R为C元素,据此结合元素周期律知识判断.
解答 解:短周期元素R、X、Y、W,W的主要化合价为+7、-1,则W为Cl元素;Y的主要化合价为+1,位于ⅠA族,其原子半径大于W(Cl),则Y为Na;X的主要化合价为-2,没有正化合价,则X为O元素;R的主要化合价为+4、-4,位于ⅣA族,原子半径大于O、小于Na,则R为C元素,
A.Y、X、W分别为Na、O、Cl,离子的电子层越多,离子半径越大,电子层相同时离子的核电荷数越大,离子半径越小,则离子半径大小为:W>X>Y,即:简单的离子半径由小到大排序:Y、X、W,故A正确;
B.非金属性越强,对应气态氢化物的稳定性越强,非金属性X(O)>R(C),则X的气态氢化物的稳定性一定比R的强,故B正确;
C.R、X和Y分别为C、O、Na元素,三种元素可以形成碳酸钠,碳酸钠是含有共价键的离子化合物,故C正确;
D.R、X、W分别为C、O、Cl元素,由于C形成的氢化物比较复杂,含有碳原子数比较多的氢化物沸点大于水,故D错误;
故选D.
点评 本题考查了原子结构与元素周期律的综合应用,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,D为易错点,注意没有指出最简单氢化物,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
10.已知电离平衡常数:H2CO3>HClO>HCO3-,氧化性:HClO>Cl2>Br2>Fe3+>I2.下列有关离子反应或离子方程式的叙述中,正确的是( )
| A. | 向0.1molFeI2溶液中滴加少量氯水,反应中有0.3NA电子转移 | |
| B. | 向溴水中加入足量氯化亚铁能使溶液变成无色 | |
| C. | 向NaClO溶液中通入少量CO2的离子方程式:2ClO-+CO2+H2O═2HClO+CO32- | |
| D. | 能使pH试纸显深红色的溶液,Fe3+、Cl-、Ba2+、Br-能大量共存 |
11.将0.04 mol/L的HCl溶液与0.08 mol/L的NaHS溶液等体积混合,所得溶液的pH<7,则下列说法正确的是( )
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
8.根据下列实验设计及有关现象,所得结论正确的是( )
| 实验 | 实验现象 | 结 论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Cu>Fe |
B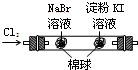 | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
C | 白色固体先变为淡黄色,后变为黑色(Ag2S) | 溶解性:AgCl>AgBr>Ag2S |
D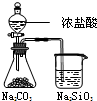 | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 酸性:HCl>H2CO3>H2SiO3 |
| A. | A | B. | B | C. | C | D. | D |
15.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 42g乙烯和丙烯的混合气体中碳原子数目一定为3NA. | |
| B. | 用惰性电极电解CuSO4溶液后,如果加入 0.1 mol Cu(OH)2能使溶液复原,则电解时产生标准状况下1.12L的气体 | |
| C. | 配制一定物质的量浓度的NaOH溶液,把NaOH固体于烧杯中充分溶解,并迅速转移到容量瓶中定容 | |
| D. | 30g的NO与O2于密闭容器中充分反应,容器内的气体分子数为1 NA. |
2.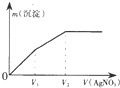 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
 往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )
往含I-和Cl-的稀溶液中逐滴加入AgNO3溶液,产生沉淀的质量m(沉淀)与加入AgNO3溶液的体积V( AgN03)的关系如图所示.已知:Ksp(AgCl)=1.8×l0-10,Ksp( AgI)=l.5×l0-16则原溶液中$\frac{c({l}^{-})}{c(C{l}^{-})}$的比值为( )| A. | $\frac{{V}_{2}-{V}_{1}}{{V}_{1}}$ | B. | $\frac{{V}_{1}}{{V}_{2}}$ | C. | $\frac{{V}_{1}}{{V}_{2}-{V}_{1}}$ | D. | $\frac{{V}_{2}}{{V}_{1}}$ |
9.下列说法正确的是( )
| A. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| B. | 吸热且熵减的非自发反应在一定条件下也可以发生 | |
| C. | 浓硝酸具有强氧化性,常温下能够溶解铁 | |
| D. | 加过量难溶电解质MnS可除去MnCl2溶液中混有的Cu2+,说明MnS的溶解度小于CuS |
6.下列官能团的名称和写法都正确的是( )
| A. | 羟基(OH-) | B. | 碳碳双键(C=C) | C. | 醛基(-COH) | D. | 羰基( ) ) |
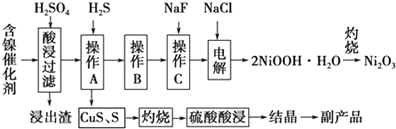
7.为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.

已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.