题目内容
18.下列关于同系物的说法不正确的是( )| A. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 含有相同官能团,且相对分子量相差14的有机物一定互为同系物 | |
| D. | 互为同系物的有机物,其化学性质相似 |
分析 A.满足通式为CnH2n+2的有机物是烷烃,互为同系物;
B.通式相同,不一定结构相似,不一定为同系物;
C.结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物,含有相同官能团,数目不一定相同;
D.同系物结构相似,其化学性质相似.
解答 解:A.满足通式为CnH2n+2的有机物是烷烃,互为同系物,所以分子式为C3H8与C6H14的两种有机物一定互为同系物,故A正确;
B.同系物一定有相同的通式,而通式相同,不一定为同系物,如均符合通式CnH2n的烯烃与环烷烃就不是同系物,故B正确;
C.含有相同官能团,且相对分子量相差14的有机物不一定互为同系物,如不是同系物,如NH2-CH2-COOH与NH2-CHNH2-COOH,相对分子量相差14,但不是同系物,故C错误;
D.结构决定分子的性质,同系物结构相似其化学性质相似,故D正确;
故选C.
点评 本题考查了同系物的判断,侧重于基础知识的考查,注意对重要有机物的结构及性质的把握,题目难度不大.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案
相关题目
11.将0.04 mol/L的HCl溶液与0.08 mol/L的NaHS溶液等体积混合,所得溶液的pH<7,则下列说法正确的是( )
| A. | 离子浓度大小关系为c(Na+)>c(Cl-)>c(HS-)>c(H+)>c(OH-) | |
| B. | c(Na+)+c(H+)=c(Cl-)+c(HS-)+c(OH-) | |
| C. | c(HS-)+c(H2S)=0.04 mol/L | |
| D. | c(H+)-c(OH-)=0.02-c(H2S)+c(S2-) |
9.下列说法正确的是( )
| A. | 目前使用的元素周期表中,最长的周期含有18种元素 | |
| B. | 吸热且熵减的非自发反应在一定条件下也可以发生 | |
| C. | 浓硝酸具有强氧化性,常温下能够溶解铁 | |
| D. | 加过量难溶电解质MnS可除去MnCl2溶液中混有的Cu2+,说明MnS的溶解度小于CuS |
6.下列官能团的名称和写法都正确的是( )
| A. | 羟基(OH-) | B. | 碳碳双键(C=C) | C. | 醛基(-COH) | D. | 羰基( ) ) |
13.己知氧化还原反应:KClO3+6HCl=KCl+3Cl2↑+3H2O 其中1mol氧化剂在反应中得到的电子为( )
| A. | 1 mol | B. | 5 mol | C. | 6 mol | D. | 2 mol |
3.下列有关生产生活中的化学,说法正确的是( )
| A. | Fe、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到 | |
| B. | 含钙、钡、铂等金属元素的物质有绚丽的颜色,可用于制造焰火 | |
| C. | 石油裂解、煤的气化、海水制镁都包含化学变化 | |
| D. | 工业上为了加快分离胶体中的电解质杂质,常在渗析袋外施加电场,使电解质离子透过半透膜向两极移动,该操作是应用胶体的电泳原理 |
10.下列离子方程式中,正确的( )
| A. | 在AlCl3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| B. | 在H2SO4溶液中加入Ba(OH)2溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
7.为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺.工艺流程如图:
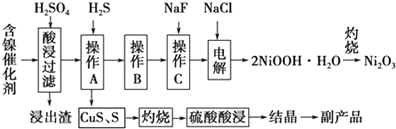
已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.

已知常温下:
①有关氢氧化物开始沉淀和沉淀完pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2[来 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
(2)浸出渣主要成分为CaSO4•2H2O和BaSO4两种物质.
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤.请对该实验方案进行评价方案错误,在调节pH前,应先在滤液中加入H2O2,使溶液中的Fe2+氧化为Fe3+(若原方案正确,请说明理由;若原方案错误,请加以改正).
(4)流程中的“副产品”为CuSO4•5H2O(填化学式).在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6mol•L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗0.1mol H2SO4.
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol•L-1,则溶液中$\frac{c(C{a}^{2+})}{c({F}^{-})}$=1.0×10-3.
(6)电解产生2NiOOH•H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为Cl-+2OH--2e-=ClO-+H2O
②Ni2+被ClO-氧化产生2NiOOH•H2O沉淀.则该步反应的离子方程式为ClO-+2Ni2++4OH-=2NiOOH•H2O↓+Cl-.
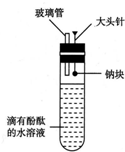 有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证:
有人设计了如图所示的实验装置,目的是做钠与水反应的实验并验证: