题目内容
16.某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)下列方法中,可制得的正确组合是D.
①MnO2和浓盐酸混合共热;
②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合;
④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热;
⑥KMnO4和浓盐酸混合.
A.①②⑥B.②④⑥C.①④⑥D.全部可以
(2)写出实验室制取Cl2的离子方程式4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+Cl2↑+Mn2+.
(3)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是随着反应的进行,盐酸浓度变稀将不再反应.
(4)①装置B的作用是证明有水蒸气产生,并吸收水蒸气,避免对后面探究氯气的性质实验产生干扰.
②装置C和D出现的不同现象说明的问题是氯气无漂白性,次氯酸有漂白性.
③装置E的作用是吸收氯气.
(5)乙同学认为甲同学的实验有缺陷,不能确定最终通入AgNO3溶液中的气体只有一种.为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置E与F之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为AC.
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水.
分析 (1)①二氧化锰在加热条件下可以氧化浓盐酸生成氯气;
②NaCl和浓硫酸加热反应生成氯化氢,氯化氢被二氧化锰氧化成氯气;
③NaClO和氯化氢发生归中反应生成氯气;
④K2Cr2O7具有强的氧化性,能够氧化浓盐酸得氯气;
⑤KClO3具有强的氧化性,能够氧化浓盐酸得氯气;
⑥KMnO4具有强的氧化性,能够氧化浓盐酸得氯气;
(2)实验室用加热二氧化锰与浓盐酸的方法制取氯气;
(3)二氧化锰只能与浓盐酸反应,与稀盐酸不反应;
(4)①依据无水硫酸铜遇水变蓝的性质用来检验在实验室制备Cl2的过程中有水蒸气挥发出来,并且吸收水蒸气;
②依据氯气没有漂白性,有漂白性的是次氯酸解答;
③应吸收氯气,防止对检验氯化氢的存在检验造成干扰;
(5)氯气、氯化氢通入到硝酸银都会产生沉淀,为了确保实验结论的可靠性,应检验氯气是否被四氯化碳完全吸收,依据氯气具有氧化性能使湿润的淀粉碘化钾试纸变蓝或者依据氯气能使湿润的有色布条褪色检验.
解答 解:(1)①二氧化锰在加热条件下可以氧化浓盐酸生成氯气,可以用①来制备氯气;
②NaCl和浓硫酸加热反应生成氯化氢,氯化氢被二氧化锰氧化成氯气,可以用②来制备氯气;
③NaClO和氯化氢发生归中反应生成氯气,可以用③来制备氯气;
④K2Cr2O7具有强的氧化性,能够氧化浓盐酸得氯气,可以用④来制备氯气;
⑤KClO3具有强的氧化性,能够氧化浓盐酸得氯气,可以用⑤来制备氯气;
⑥KMnO4具有强的氧化性,能够氧化浓盐酸得氯气,可以用⑥来制备氯气;
故选:D;
(2)加热二氧化锰与浓盐酸生成氯气、氯化锰和水,离子方程式:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+Cl2↑+Mn2+;
故答案为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$ 2H2O+Cl2↑+Mn2+;
(3)若用含有0.2mol HCl的浓盐酸与足量的MnO2反应制得Cl2,若氯化氢全部反应,则生成氯气的体积(标况下)等于1.12L,但是随着反应的进行,盐酸浓度变稀将不再反应,所以生成氯气的体积(标况下)小于1.12L;
故答案为:随着反应的进行,盐酸浓度变稀将不再反应;
(4)①无水硫酸铜遇水变蓝,并且能够吸收水蒸气,故用B装置检验有水蒸气挥发出来,并且吸收水蒸气,避免对后面探究氯气的性质实验产生干扰,
故答案为:用B装置检验有水蒸气挥发出来,并且吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;
②氯气没有漂白性,有漂白性的是次氯酸,
故答案为:氯气没有漂白性,有漂白性的是次氯酸;
③吸收氯气,防止对检验氯化氢的存在检验造成干扰,
故答案为:吸收氯气;
(5)氯气、氯化氢通入到硝酸银都会产生沉淀,为了确保实验结论的可靠性,应在装置E和F之间增加一个盛有湿润的淀粉碘化钾试纸或者湿润的有色布条,如果湿润的淀粉碘化钾试纸不变蓝或者湿润的有色布条不褪色,则氯气被完全吸收,
故答案为:E;F;AC.
点评 本题以氯气的制备为载体考查了氯气的性质,题目综合性较强,侧重考查依据所学知识分析问题、解决问题的能力,难度中等.

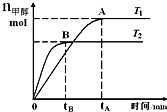 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大 | |
| B. | CO合成甲醇的反应为吸热反应 | |
| C. | 该反应在T1时的平衡常数比T2时的小 | |
| D. | 该反应平衡常数可表示为K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ |
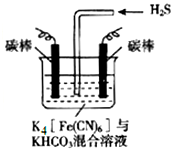 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| B. | 电解时阴极反应式为:2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- |
| A. |  电解冶炼铝 | B. |  电动车行驶中 | C. |  火箭升天 | D. |  风力发电 |
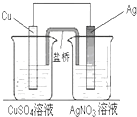 用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )
用铜片、银片、CuSO4溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是 ( )①在外电路中,电子由铜电极流向银电极
②正极反应为:Ag++e-═Ag
③盐桥中K+移向CuSO4溶液
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池总反应相同.
| A. | ①② | B. | ③④ | C. | ①②④ | D. | ①②③④ |
| A. | 烧碱 NaOH | B. | 碱石灰 CaO | C. | 纯碱 Na2CO3 | D. | 小苏打 NaHCO3 |
| A. | 热稳定性NaHCO3<Na2CO3 | B. | 常温时水中溶解度NaHCO3>Na2CO3: | ||
| C. | 与盐酸反应的速率:NaHCO3>Na2CO3 | D. | 相对分子质量:NaHCO3<Na2CO3 |
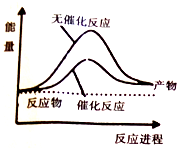 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下| H2(g) | CO(g) | CH3OH(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 1084 | a |
| A. | 上图可表示合成甲醇过程中的能量变化 | |
| B. | a的数值为2047 | |
| C. | Q的数值为91 | |
| D. | 其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量 |
 甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.