题目内容
7.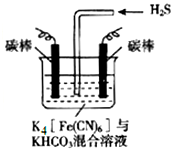 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| B. | 电解时阴极反应式为:2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- |
分析 A、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中不需要不断补充K4[Fe(CN)6]与KHCO3;
B、阴极发生还原反应,电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电;
C、根据2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S和阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,得到关系式为:H2↑~2CO32-~S根据计算求解;
D、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高.
解答 解:A、因后来发生反应为2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S,所以整个过程中需要不断补充硫化氢,故A错误;
B、电解质溶液中的阴极离子碳酸氢根离子,电离产生氢离子在阴极放电,所以电极反应式为2HCO3-+2 e-═H2↑+2CO32-,故B正确;
C、根据2Fe(CN)63-+2CO32-+H2S=2Fe(CN)64-+2HCO3-+S和阴极反应式为2HCO3-+2 e-═H2↑+2CO32-,得到关系式为:H2↑~2CO32-~S,所以22.4L标准状况下的H2生成时,溶液中有32gS析出,故C正确;
D、电解时阳极发生失电子的氧化反应,先将[Fe(CN)6]4-转化为Fe(CN)6]3-,化合价升高,所以反应为:[Fe(CN)6]4--e-═[Fe(CN)6]3-,故D正确;
故选A.
点评 本题主要考查了利用电解原理来判断电极方程式、转移电子数等,难度不大,抓住电解的原理分析阴阳极的反应是解题的根本.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
19.按要求完成表格:
| 实验要求 | 所加试剂 | 主要操作 |
| 除去NaCl溶液中混有的I2 | 苯或四氯化碳 | 萃取、分液 |
| 除去NO气体中混有的NO2 | 水 | 洗气 |
| 除去SiO2固体中混有的Al2O3 | 盐酸 | 过滤 |
| 除去Fe2(SO4)3溶液混有的FeSO4溶液 | 过氧化氢 | ------ |
15.干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )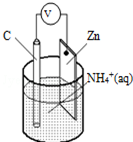

| A. | 碳为电池的负极 | B. | Zn极上发生氧化反应 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
12.锌铜原电池装置如图所示,其中阴离子交换膜只允许阴离子和水分子通过,下列有关叙述正确的是( )
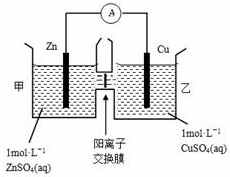

| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
19.已知:(NH4)2CO3(s)═NH4HCO3(s)+NH3(g)△H=+74.9kJ•mol-1,下列说法中正确的是( )
| A. | 该反应中熵变小于0、焓变大于0 | |
| B. | 判断反应能否自发进行需要根据△H与△S综合考虑 | |
| C. | 该反应是吸热反应,因此一定不能自发进行 | |
| D. | 碳酸盐分解反应中熵增加,因此任何条件下所有碳酸盐分解一定自发进行 |