题目内容
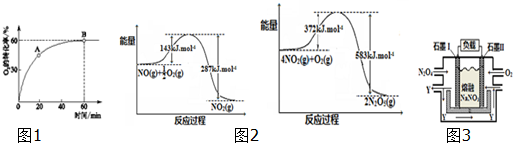
6. 在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )
在恒容密闭的容器中,由CO合成甲醇:CO(g)+2H2(g)?CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是( )| A. | 处于A点的反应体系从T1变到T2,达到平衡时$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大 | |
| B. | CO合成甲醇的反应为吸热反应 | |
| C. | 该反应在T1时的平衡常数比T2时的小 | |
| D. | 该反应平衡常数可表示为K=$\frac{c(C{H}_{3}OH)}{c(CO)c({H}_{2})}$ |
分析 A.由图可知,处于A点的反应体系从T1变到T2,温度增大,平衡向逆反应方向移动;
B.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1,温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,逆向为吸热反应;
C.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动;
D.化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值.
解答 解:A.由图可知,处于A点的反应体系从T1变到T2,温度增大,平衡向逆反应方向移动,氢气物质的量增大,甲醇的物质的量减小,$\frac{n({H}_{2})}{n(C{H}_{3}OH)}$增大,故A正确;
B.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,所以合成甲醇的反应为放热反应,故B错误;
C.由图可知,T2温度下到达平衡所以时间较短,反应速率较快,故温度T2>T1.温度越高,平衡时甲醇的物质的量越小,说明升高温度平衡向逆反应方向移动,化学平衡常数降低,在T1时的平衡常数比T2时的大,故C错误;
D.CO(g)+2H2(g)?CH3OH(g)的平衡常数表达式K=$\frac{c(C{H}_{3}OH)}{c(CO){c}^{2}({H}_{2})}$,故D错误;
故选A.
点评 本题考查化学平衡图象、化学平衡影响因素、化学平衡常数等,难度中等,注意理解外界条件对化学平衡的影响.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案
相关题目
18.如图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系.下列说法一定正确的是( )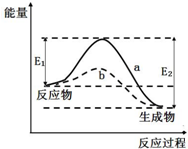

| A. | 该反应△H>0 | B. | a与b相比,a的反应速率更快 | ||
| C. | a与b相比,反应的平衡常数Ka=Kb | D. | 反应物总键能大于生成物总键能 |
19.按要求完成表格:
| 实验要求 | 所加试剂 | 主要操作 |
| 除去NaCl溶液中混有的I2 | 苯或四氯化碳 | 萃取、分液 |
| 除去NO气体中混有的NO2 | 水 | 洗气 |
| 除去SiO2固体中混有的Al2O3 | 盐酸 | 过滤 |
| 除去Fe2(SO4)3溶液混有的FeSO4溶液 | 过氧化氢 | ------ |
1.下列四种化学操作名称从左到右分别是( )
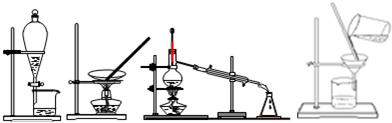

| A. | 过滤、蒸发、蒸馏、萃取 | B. | 过滤、蒸馏、蒸发、萃取 | ||
| C. | 蒸发、蒸馏、过滤、萃取 | D. | 萃取、蒸发、蒸馏、过滤 |
15.干电池原理示意图如图,电池总反应为:Zn+2NH4+═Zn2++2NH3↑+H2↑,下列说法正确的是( )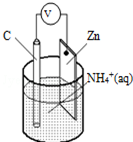

| A. | 碳为电池的负极 | B. | Zn极上发生氧化反应 | ||
| C. | 电流由锌极流向碳极 | D. | H2在Zn片上生成 |
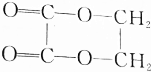 的化学方程式(无机试剂任选)并注明反应类型.
的化学方程式(无机试剂任选)并注明反应类型. (取代反应).
(取代反应).