题目内容
8.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2800kJ•mol-1;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为( )| A. | 4.5 g | B. | 810 g | C. | 1250 g | D. | 900 g |
分析 由热化学方程式可知,1mol葡萄糖燃烧放出热量为2800kJ,根据消耗的热量计算需要葡萄糖的物质的量,再根据m=nM计算葡萄糖的质量.
解答 解:由C6H12O6(s)+6O2(g)→6CO2(g)+6H2O(l)△H=-2800KJ/mol,可知某人每天消耗12600KJ热量需要葡萄糖的物质的量为$\frac{12600kJ}{2800kJ/mol}$,则需要葡萄糖的质量为:$\frac{12600kJ}{2800kJ/mol}$×180g/mol=810g,
故选:B.
点评 本题考查反应热有关计算,比较基础,关键是对热化学方程式意义的理解.

练习册系列答案
相关题目
18.将0.4molAgNO3,0.8mol Cu(NO3)2,0.8molKCl液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另 一个电极上放出气体的体积(标准状况)约为( )
| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
19.欲配制100mL 1.0mol•L-1Na2SO4溶液,正确的方法是( )
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L-1Na2SO4溶液用水稀释至100mL.
①将14.2g Na2SO4溶于100mL水中
②将32.2gNa2SO4•10H2O溶于少量水 中,再用水稀释至100mL
③将20mL 5.0mol•L-1Na2SO4溶液用水稀释至100mL.
| A. | ①② | B. | ②③ | C. | ① | D. | ①②③ |
16.现有氧化铝、石灰石、二氧化硅三种白色粉末,若用一种试剂将它们区别开来,此试剂是( )
| A. | 水 | B. | 盐酸 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
3.下列除杂质的方法不正确的是( )
| A. | 铜粉中混有铁粉:加入过量盐酸充分反应,过滤 | |
| B. | CO2中混有HCl:将其通入NaOH溶液,洗气 | |
| C. | NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 | |
| D. | FeCl2溶液中混有少量FeCl3:加入Fe粉 |
13.下列关于钠的叙述错误的是( )
| A. | 实验后剩余少量钠可放回原试剂瓶中 | |
| B. | 用一般的化学还原法不能制取金属钠 | |
| C. | 某物质的焰色反应为黄色,则该物质一定含钠元素 | |
| D. | 钠可以用少量水密封保存 |
20.下列分散系中,不 能发生丁达尔效应的是( )
| A. | 豆浆 | B. | 牛奶 | C. | Ca(OH)2悬浊液 | D. | 烟、云、雾 |
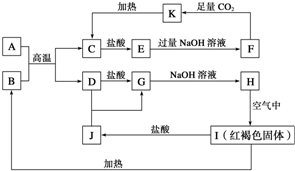 已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.
已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.