题目内容
18.将0.4molAgNO3,0.8mol Cu(NO3)2,0.8molKCl液1L用惰性电极电解一段时间后,在一个电极上析出0.3molCu,此时在另 一个电极上放出气体的体积(标准状况)约为( )| A. | 5.6L | B. | 6.72L | C. | 2.8L | D. | 13.44L |
分析 首先发生反应:Ag++Cl-=AgCl↓,Ag+完全反应,剩余Cl-为0.4mol,阴极发生反应:Cu2++2e-=Cu,阴析出0.3molCu,原溶液中n(Cu2+)=0.8mol>0.3mol,则溶液中Cu2+未完全放电,阳极获得电子为0.3mol×2=0.6mol.阳极先发生反应:2Cl--2e-=Cl2↑,0.8mol Cl-完全放电失去电子为0.8mol,大于0.6mol,Cl-未完全放电,根据电子转移守恒生成氯气物质的量,进而计算生成气体体积.
解答 解:首先发生反应:Ag++Cl-=AgCl↓,0.4mol Ag+完全反应消耗0.4molCl-,则剩余Cl-为0.4mol,阴极发生反应:Cu2++2e-=Cu,阴析出0.3molCu,原溶液中n(Cu2+)=0.8mol>0.3mol,则溶液中Cu2+未完全放电,阳极获得电子为0.3mol×2=0.6mol.
阳极先发生反应:2Cl--2e-=Cl2↑,0.8mol Cl-完全放电失去电子为0.8mol,大于0.6mol,Cl-未完全放电,阳极生成气体为氯气,根据电子转移守恒,生成氯气物质的量为$\frac{0.6mol}{2}$=0.3mol,故生成气体体积为0.3mol×22.4L/mol=6.72L,
故选:B.
点评 本题考查电解原理及有关计算,属于易错题目,学生容易根据离子放电顺序解答,忽略银离子与氯离子反应,难度中等.

练习册系列答案
相关题目
9.下列说法正确的是( )
| A. | 检验某酸性溶液中Cl-和SO42-,选用试剂及顺序是过量Ba(NO3)2溶液、AgNO3溶液 | |
| B. | 将足量CO2和SO2的混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都无沉淀生成 | |
| C. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
6.下列有关物质性质或反应的说法正确的是( )
| A. | 石油的裂化、裂解和煤的干馏都是化学变化 | |
| B. | 苯和浓溴水在溴化铁作催化剂的条件下反应生成溴苯 | |
| C. | 制备聚苯乙烯和制备酚醛树脂的反应均属于加聚反应 | |
| D. | 淀粉、油脂和蛋白质都是高分子化合物,都能发生水解反应 |
13.锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )
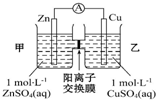

| A. | 铜电极上发生反应Cu-2e-=Cu2+ | |
| B. | 电池工作一段时间后,乙池的c(SO42- )减小 | |
| C. | 电子从锌极经过导线移向铜极 | |
| D. | 电池工作一段时间后,甲池的c(Zn2+ )增加 |
3.某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Al3+和K+.取该溶液200mL,加入过量浓NaOH溶液,加热,得到448mL气体(标准状况下测定),同时产生红褐色沉淀;过滤,洗涤,灼烧,得到3.2g固体;向上述滤液中加足量BaCl2溶液,得到9.32g不溶于盐酸的沉淀.由此可知原溶液中( )
| A. | 至少存在5种离子 | |
| B. | SO42ˉ、NH4+一定存在,Clˉ可能不存在 | |
| C. | Clˉ一定存在,且c(Clˉ)≥0.3mol/L | |
| D. | CO32ˉ、Al3+一定不存在,K+可能存在 |
7.对气体反应:mA+nB?eC,温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是( )
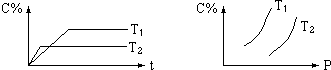
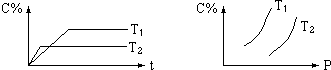
| A. | T1<T2 | B. | m+n<e | ||
| C. | 正反应是吸热反应 | D. | 逆反应是放热反应 |
8.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2800kJ•mol-1;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为( )
| A. | 4.5 g | B. | 810 g | C. | 1250 g | D. | 900 g |