题目内容
16.现有氧化铝、石灰石、二氧化硅三种白色粉末,若用一种试剂将它们区别开来,此试剂是( )| A. | 水 | B. | 盐酸 | C. | 氢氧化钠溶液 | D. | 硝酸银溶液 |
分析 氧化铝与盐酸反应生成氯化铝和水,石灰石与盐酸反应生成气体,二氧化硅与盐酸不反应,以此来解答.
解答 解:A.均不溶于水,不能鉴别,故A不选;
B.氧化铝与盐酸反应生成氯化铝和水,石灰石与盐酸反应生成气体,二氧化硅与盐酸不反应,现象不同,可鉴别,故B选;
C.氧化铝、二氧化硅均与NaOH溶液反应生成无色溶液,故C不选;
D.均与硝酸银不反应,不能鉴别,故D不选;
故选B.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、性质差异及发生的反应和现象为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
6.下列有关物质性质或反应的说法正确的是( )
| A. | 石油的裂化、裂解和煤的干馏都是化学变化 | |
| B. | 苯和浓溴水在溴化铁作催化剂的条件下反应生成溴苯 | |
| C. | 制备聚苯乙烯和制备酚醛树脂的反应均属于加聚反应 | |
| D. | 淀粉、油脂和蛋白质都是高分子化合物,都能发生水解反应 |
7.对气体反应:mA+nB?eC,温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是( )
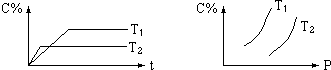
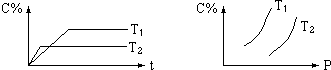
| A. | T1<T2 | B. | m+n<e | ||
| C. | 正反应是吸热反应 | D. | 逆反应是放热反应 |
4.下列有关物质的性质或应用的说法正确的是( )
| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 等质量的乙烷、乙烯、乙炔在氧气中完全燃烧,乙烷消耗的氧气最多 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
1. 现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
 现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )
现有FeCl3、AlCl3的混合溶液250mL,逐滴加入NaOH溶液,生成沉淀的物质的量随加入的NaOH的物质的量的关系如图所示,则混合液中FeCl3的物质的量浓度是( )| A. | 0.4 mol/L | B. | 1.8 mol/L | C. | 1.6 mol/L | D. | 1.2 mol/L |
8.人体内葡萄糖的消耗可用下列热化学方程式表示:C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l)△H=-2800kJ•mol-1;如果某人每天消耗12600kJ热量,则他每天至少要摄入葡萄糖的质量为( )
| A. | 4.5 g | B. | 810 g | C. | 1250 g | D. | 900 g |
5.下列各组物质中,不是同分异构体的是( )
| A. | 正丁烷、2-甲基丙烷 | B. | 蔗糖、麦芽糖 | ||
| C. | 乙醇、二甲醚 | D. | 淀粉、纤维素 |
6.碳及其化合物有广泛的用途.
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
①其它条件不变,降低温度,达到新平衡前v(逆)<v(正)(填“>”、“<”或“=”).
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).