题目内容
18.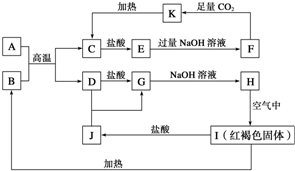 已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.
已知A~K均为中学化学的常见物质,它们之间的转化关系如下图所示,其中A是铝,且A+B→C+D是置换反应,反应过程中生成的水及其他部分产物已略去.请回答以下问题:
(1)B的主要用途是油漆颜料(填一项).
(2)写出下列化学方程式:
A+B→C+D:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3.H→I:4Fe(OH)2+O2+2H2O=4Fe(OH)3.I→B:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O.
(3)写出下列离子方程式:F→K:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-.
(4)检验J中阳离子的方法是取少量溶液于小试管中,滴加几滴KSCN溶液,若溶液出现红色,说明含有Fe3+.
分析 红褐色固体I为Fe(OH)3,则B为Fe2O3,A是铝,且A+B→C+D是置换反应,D系列转化得到氢氧化铁,则D为Fe,C为Al2O3,可推知G为FeCl2、H为Fe(OH)2、J为FeCl3,E为AlCl3,F为NaAlO2、K为Al(OH)3,据此解答.
解答 解:红褐色固体I为Fe(OH)3,则B为Fe2O3,A是铝,且A+B→C+D是置换反应,D系列转化得到氢氧化铁,则D为Fe,C为Al2O3,可推知G为FeCl2、H为Fe(OH)2、J为FeCl3,E为AlCl3,F为NaAlO2、K为Al(OH)3.
(1)B为Fe2O3,可以用作油漆颜料,故答案为:油漆颜料;
(2)A+B→C+D的反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,
H→I的反应方程式为:4Fe(OH)2+O2+2H2O=4Fe(OH)3,
I→B的反应方程式为:2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;4Fe(OH)2+O2+2H2O=4Fe(OH)3;2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O;
(3)F→K的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(4)检验FeCl3中阳离子的方法是:取少量溶液于小试管中,滴加几滴KSCN溶液,若溶液出现红色,说明含有Fe3+,
故答案为:取少量溶液于小试管中,滴加几滴KSCN溶液,若溶液出现红色,说明含有Fe3+.
点评 本题考查无机物推断,涉及Al、Fe元素单质化合物的性质,物质的颜色是推断突破口,注意对基础知识的掌握,难度中等.

| A. | 4.5 g | B. | 810 g | C. | 1250 g | D. | 900 g |
| A. | H+、SO42-、CO32-、K+ | B. | Fe3+、Na+、OH-、NO3- | ||
| C. | Mg2+、Al3+、Cl-、SO42- | D. | Na+、Cl-、OH-、NH4+ |
(1)反应C(s)+H2O(g)?CO(g)+H2(g)△H=+131.3kJ•mol-1,达到平衡后,体积不变时,以下有利于提高H2产率的措施是BC.
A.增加碳的用量 B.升高温度
C.用CO吸收剂除去CO D.加入催化剂
(2)已知,C(s)+CO2(g)?2CO(g)△H=+172.5kJ•mol-1
则反应 CO(g)+H2O(g)?CO2(g)+H2(g) 的△H=-41.2kJ•mol-1.
(3)在一定温度下,将CO(g)和H2O(g)各0.16mol分别通入到体积为2.0L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下数据:
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
②该温度下,此反应的平衡常数K=$\frac{9}{25}$;
③其它条件不变,再充入0.1mol CO和0.1mol H2O(g),达到平衡时CO的体积分数不变(填“增大”、“减小”或“不变”).
| A. | 甲苯既可使溴的四氯化碳溶液褪色,也可使酸性高锰酸钾溶液褪色 | |
| B. | 有机物 在强碱的醇溶液中可以发生消去反应 在强碱的醇溶液中可以发生消去反应 | |
| C. | 有机物A(C4H6O2)能发生加聚反应,可推知A的结构一定是CH2=CH-COOCH3 | |
| D. | 可用新制Cu(OH)2悬浊液鉴别甲酸、乙酸、甲酸乙酯、乙酸甲酯这四种物质 |
| A. | 滴有酚酞的NaOH溶液中通入SO2气体,溶液红色消失,证明SO2具有漂白性 | |
| B. | 配制一定物质的量浓度的溶液,定容时俯视容量瓶的刻度线,会造成所配溶液浓度偏高 | |
| C. | 硅单质是制造光导纤维的材料 | |
| D. | 氯水放置数天后,pH会变大 |
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1 mo1/L盐酸中含1 mo1HCl分子 | |
| C. | 在标准状况下,22.4 LCH4与18gH2O所含有的分子数均为NA | |
| D. | 22.4L的CO气体与1mol N2所含的电子数一定相等 |
| A. | 盐酸 | B. | 蛋白质胶体 | C. | KOH溶液 | D. | NaCl溶液 |