题目内容
 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:| 元素 | A | B | C | D | E |
| 相关 信息 |
最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
(1)C在元素周期表中的位置是
(2)B、D元素对应的相对分子质量最小的氢化物受热分解所需温度B
(3)检验E3+离子的方法是
(4)鉴别D的两种氧化物的试剂是
(5)0.1mol?L-1C2D溶液中各种离子浓度从大到小的顺序是
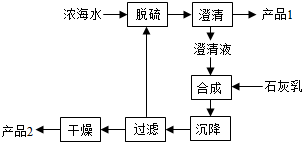
(6)AO2、O2和熔融NaAO3可制作燃料电池,其原理如图所示.该电池在使用过程电极Ⅰ生成氧化物Y,写出电极Ⅱ的反应式
考点:位置结构性质的相互关系应用,热化学方程式,常见化学电源的种类及其工作原理
专题:元素周期律与元素周期表专题,电化学专题
分析:A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,C单质质软,通常保存在煤油中,则C为Na;B与元素C可形成离子个数比为2:1和1:1的化合物,则B为O元素;A的最高正价与最低负价代数和为2,处于ⅤA族,原子序数小于O,则A为N元素;D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,则D为S元素;E单质是用途最广泛的金属,人体缺少该元素易患贫血症,则E为Fe,据此解答.
解答:
解:A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,C单质质软,通常保存在煤油中,则C为Na;B与元素C可形成离子个数比为2:1和1:1的化合物,则B为O元素;A的最高正价与最低负价代数和为2,处于ⅤA族,原子序数小于O,则A为N元素;D元素可形成两种氧化物,其中一种是形成酸雨的主要成分,则D为S元素;E单质是用途最广泛的金属,人体缺少该元素易患贫血症,则E为Fe,
(1)C为Na,在元素周期表中的位置是:第三周期第ⅠA族,
故答案为:第三周期第ⅠA族;
(2)非金属性O>S,故氢化物稳定性H2O>H2S,故分解温度H2O>H2S,
故答案为:>;
(3)检验Fe3+离子的方法是:取少量样品于试管中,滴加KSCN溶液,若溶液显红色,则含有Fe3+,
故答案为:取少量样品于试管中,滴加KSCN溶液,若溶液显红色,则含有Fe3+;
(4)D为S元素,其两种氧化物为SO2、SO3,二氧化硫具有漂白性,能使品红溶液褪色,而三氧化硫不能,故用品红溶液鉴别,常温常压下SO2与一氧化碳反应生成 1.6g S单质与另一种氧化物,该氧化物为CO2,并放出14.86kJ的热量,生成1molS(s)放出的热量=14.86kJ×
=297.2kJ,故此反应的热化学方程式为:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-297.2kJ/mol,
故答案为:品红溶液;SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-297.2kJ/mol;
(5)0.1mol?L-1Na2S溶液中S2-离子水解:S2-+H2O?HS-+OH-,HS-进一步水解:HS-+H2O?H2S+OH-,故溶液呈碱性,且c(Na+)>c(S2-),HS-的水解远小于S2-水解,c(OH-)比c(HS-)稍大一些,水解程度微弱,故c(S2-)>c(OH-),碱性条件下氢离子浓度很小,各种离子浓度从大到小的顺序是:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(6)由图可知,NO2、在电极Ⅰ放电,氧气在电极Ⅱ放电,故电极Ⅰ发生氧化反应,电极Ⅱ发生还原反应,该电池在使用过程电极Ⅰ生成氧化物Y为N2O5,电极Ⅱ为氧气获得电子,在N2O5参与反应条件下生成NO3-,电极Ⅱ的电极反应式为:O2+2N2O5+4e-=4NO3-,
故答案为:O2+2N2O5+4e-=4NO3-.
(1)C为Na,在元素周期表中的位置是:第三周期第ⅠA族,
故答案为:第三周期第ⅠA族;
(2)非金属性O>S,故氢化物稳定性H2O>H2S,故分解温度H2O>H2S,
故答案为:>;
(3)检验Fe3+离子的方法是:取少量样品于试管中,滴加KSCN溶液,若溶液显红色,则含有Fe3+,
故答案为:取少量样品于试管中,滴加KSCN溶液,若溶液显红色,则含有Fe3+;
(4)D为S元素,其两种氧化物为SO2、SO3,二氧化硫具有漂白性,能使品红溶液褪色,而三氧化硫不能,故用品红溶液鉴别,常温常压下SO2与一氧化碳反应生成 1.6g S单质与另一种氧化物,该氧化物为CO2,并放出14.86kJ的热量,生成1molS(s)放出的热量=14.86kJ×
| 1mol×32g/mol |
| 1.6g |
故答案为:品红溶液;SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-297.2kJ/mol;
(5)0.1mol?L-1Na2S溶液中S2-离子水解:S2-+H2O?HS-+OH-,HS-进一步水解:HS-+H2O?H2S+OH-,故溶液呈碱性,且c(Na+)>c(S2-),HS-的水解远小于S2-水解,c(OH-)比c(HS-)稍大一些,水解程度微弱,故c(S2-)>c(OH-),碱性条件下氢离子浓度很小,各种离子浓度从大到小的顺序是:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),
故答案为:c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+);
(6)由图可知,NO2、在电极Ⅰ放电,氧气在电极Ⅱ放电,故电极Ⅰ发生氧化反应,电极Ⅱ发生还原反应,该电池在使用过程电极Ⅰ生成氧化物Y为N2O5,电极Ⅱ为氧气获得电子,在N2O5参与反应条件下生成NO3-,电极Ⅱ的电极反应式为:O2+2N2O5+4e-=4NO3-,
故答案为:O2+2N2O5+4e-=4NO3-.
点评:本题考查结构性质位置关系应用,涉及元素周期律、离子检验、热化学方程式、离子浓度比较、原电池原理等,推断元素是解题关键,(6)为难点,注意根据各电极物质及原电池发生的氧化还原反应进行分析.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列对应化学反应的离子方程式正确的是( )
| A、氨水中通入过量SO2:SO2+NH3?H2O═NH4++HSO3- | ||||
| B、(CH3COO)2Ba溶液中加入稀硫酸:Ba2++SO42-═BaSO4↓ | ||||
C、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| D、Al2(SO4)3溶液中加入足量Ba(OH)2溶液:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A、
| ||
| B、0.1mol?L-1 FeCl3溶液:NH4+、H+、I-、SCN- | ||
| C、0.1mol?L-1 Na2CO3溶液:K+、Ca2+、HCO3-、SO42- | ||
| D、使酚酞变红色的溶液:Na+、Ba2+、NO3-、Cl- |
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为:4CuI+Hg═Cu2HgI4+2Cu.下列说法中正确的是( )
| A、该反应的氧化剂为CuI,氧化产物为Cu |
| B、产物Cu2HgI4中,Cu元素的化合价为+2 |
| C、当有2mol CuI参与反应时,转移电子为1mol |
| D、由Cu2+与I直接反应制得CuI的离子方程式为Cu2++I-=CuI |
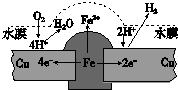 铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如图.下列说法不正确的是( )| A、因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B、若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C、铜极上的反应是2H++2e-═H2↑,O2+4e-+4H+═2H2O |
| D、在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |


 通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.