题目内容
9.某化学学习小组设计如图实验装置(夹持和加热装置略去)制备Cl2,并探究氯气的相关性质.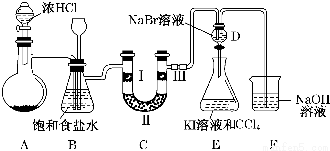
(1)若A装置中固体药品为MnO2,其化学方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
(2)装置B的作用:除去氯气中的氯化氢,检测实验过程中装置C是否发生堵塞.
(3)装置C的作用是验证氯气是否具有漂白性,Ⅰ处是湿润的有色布条,则Ⅱ、Ⅲ处应加入的物质分别是无水氯化钙、干燥的有色布条.
(4)设计装置D、E的目的是比较氯、溴、碘的氧化性,反应一段时间后关闭D取下E并充分振荡,可观察到E中的现象为E中溶液分为两层,上层为紫红色.
(5)请用化学方程式说明装置F的作用:Cl2+2NaOH=NaCl+NaClO+H2O.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯气;
(2)浓盐酸易挥发制取的氯气中含有氯化氢,用饱和食盐水可以吸收氯化氢;B装置还能够检测实验过程中装置C是否发生堵塞;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘;
(5)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠反应,能够被氢氧化钠吸收;
(6)亚硫酸钠溶液中 通入氯气反应生成硫酸钠,同时生成的盐酸和亚硫酸钠反应会生成污染气体二氧化硫.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯气,化学方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,用饱和食盐水可以吸收氯化氢;
故答案为:除去氯气中的氯化氢,检测实验过程中装置C是否发生堵塞;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,Ⅱ中应是干燥剂无水氯化钙,湿润的氯气通过干燥除去水分,通过Ⅲ处干燥的有色布条,布条不褪色;
故答案为:无水氯化钙,干燥的有色布条;
(4)D、E的目的是比较氯、溴、碘的非金属性,D中发生氯气与NaBr的反应生成溴,打开活塞,将装置D中少量溶液加入装置E中,氯气、溴均可与KI反应生成碘,则E中碘易溶于苯,出现分层后上层为紫红色的苯层,故答案为:E中溶液分为两层,上层为紫红色;
(5)氯气有毒,直接排放容易造成空气污染,氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水,方程式为:Cl2+2NaOH=NaCl+NaClO+H2O;
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
点评 本题考查性质实验方案的制备,为高频考点,把握氯气的性质、制法、装置的作用及氧化还原反应原理为解答的关键,侧重分析能力、实验能力及知识综合应用能力的综合考查,题目难度中等.

| A. | 氮肥NH4NO3在重力撞击下可能发生爆炸 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 单质硅可用于制备太阳能电池板,二氧化硅可用于制作光导纤维 | |
| D. | 聚酯纤维、碳纤维、光导纤维都属于有机高分子材料 |
 又名萘,则萘的化学式为( )
又名萘,则萘的化学式为( )| A. | C10H10 | B. | C10H8 | C. | C12H10 | D. | C10H12 |
| A. | 氯原子: | B. | OH-离子: | ||
| C. | NH3 | D. | HCl的形成过程: |
| A. | 石油的分馏和煤的干馏都属于物理变化 | |
| B. | 通过对95%的酒精直接蒸馏获得无水酒精 | |
| C. | 在石油的分馏、实验室制乙烯以及制备硝基苯的三个实验中,温度计水银球的位置分别位于蒸馏烧瓶支管口、反应液液面以下、水浴中 | |
| D. | 用C8H18萃取溴水中的溴,可观察到溶液分层,下层为橙红色,上层接近无色 |
| A. | 一分子H2和Cl2反应,放出热量184.6 kJ | |
| B. | 1mol H2和Cl2完全反应生成2mol HCl放出的热量为184.6kJ | |
| C. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,放出的热量为184.6 kJ | |
| D. | 在25℃、101kPa时,1mol气态H2和1mol气态Cl2完全反应生成2mol HCl气体,吸收的热量为184.6kJ |
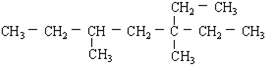 的名称3,5-二甲基-3-乙基庚烷
的名称3,5-二甲基-3-乙基庚烷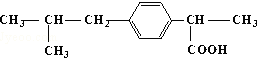 所含官能团的名称羧基
所含官能团的名称羧基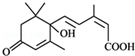 所含官能团的名称碳碳双键、羟基、羰基、羧基.
所含官能团的名称碳碳双键、羟基、羰基、羧基. 化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.
化学与人类生产和生活中密切相关,掌握有关的化学基础知识可以改善我们的生活.