��Ŀ����
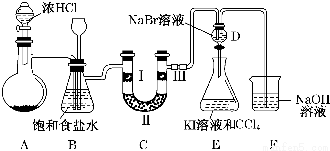
17��ijѧУ����С����Խ̲���ͭ��Ũ���ᷴӦ������ˡ��ܹ���ͭ��Ӧ����������Ũ���Ƕ��٣�����̽�����⣬����������·�������ʵ�飺ʵ���Լ���18mol/L����20mL����ͭ������������2mol/LNaOH��Һ�������ʵ��ش����⣺��1�����ȸ���ͼ��ʾ����װʵ��װ�ã����ڼ����Լ�ǰ�Ƚ��м���װ�������Բ�����
��2���ձ�����NaOH��Һ���յ�������SO2 ���õ��õ�©�������ǽ�������ֱ�������ձ��е�Ŀ���ǣ���������
��3��������ƿ20���ӣ���ƿ�з�����Ӧ�Ļ�ѧ����ʽ�ǣ�Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
��4������ַ�Ӧ����ձ�ȡ�£������м���������˫��ˮ���ټ���������BaCl2��Һ���ٽ��й��ˡ�ϴ�ӡ������������������Ϊ13.98g�����������ͭ��Ӧ����������Ũ����12mol/L��
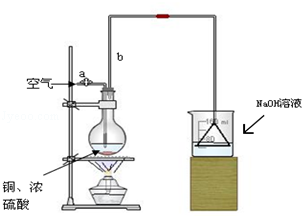
���� ��1���л���������������װ��ʵ��ǰ�������װ�������ԣ�
��2�����������£�Ũ�����Cu��Ӧ���ɶ���������������������������ܺͼӦ���Ҷ��������ж�������ֱ���ſգ�
��3�����������£�Ũ�����Cu��Ӧ��������ͭ�����������ˮ��װ���г������ܼ��������������ã�ʹˮ��������������
��4��������������������������Ϊ�����ƣ������Ȼ�����Һ��Ӧ�������ᱵ������ͨ�����ˡ�ϴ�ӡ�����õ���������������Ԫ�����ʵ�����������Ԫ���غ��ϻ�ѧ����ʽ������Ҫ��Ӧ���������Ũ�ȣ�
��� �⣺��1��ʵ��װ�����Ʊ�������������ķ���װ�ã���ʵ��ǰ��Ҫ����װ�������ԣ���ֹװ��©��Ӱ��ʵ�飬
�ʴ�Ϊ������װ�������ԣ�
��2��������������Ⱦ�����岻���ŷŵ������У���Ҫ������������Һ���գ����õ��õ�©�������ǽ�������ֱ�������ձ����Ƿ�ֹҺ�嵹����
�ʴ�Ϊ��SO2����������
��3����ƿ����ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��װ���г������ܼ��������������ã�ʹˮ������������������ȷ��������Һ������ֲ�������ã�
�ʴ�Ϊ��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��
��4��������������������������Ϊ�����ƣ������Ȼ�����Һ��Ӧ�������ᱵ������ͨ�����ˡ�ϴ�ӡ�����õ��������������������Ϊ13.98gΪ���ᱵ���������ʵ���=$\frac{13.98g}{233g/mol}$=0.06mol��������Ԫ���غ㣬������������Ϊ0.06mol�����ݻ�ѧ����ʽ��֪��Cu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O����Ӧ���������ʵ���Ϊ0.12mol��ʣ���������ʵ���=18mol/L��0.020L-0.12mol=0.24mol��ʣ����Ҫ�����Ũ��=$\frac{0.24mol}{0.02L}$=12mol/L��
�ʴ�Ϊ�����ˣ�ϴ�ӣ����12mol/L��
���� ������Ũ�����Cu�ķ�ӦΪ���忼������ʵ�鷽����ƣ�Ϊ��Ƶ���㣬�漰�������㡢����������������ԭ��Ӧ��֪ʶ�㣬��ȷʵ��������������������ǽⱾ��ؼ���֪�������������ò�ע��ʵ������淶�ԣ���Ŀ�ѶȲ���

| A�� | CH2O��C2H4O2��C6H12O6 | B�� | C6H6O��C5H10��C7H6O2 | ||
| C�� | C2H4��C2H5OH��HOCH2CH2COOH | D�� | H2��CO��CH3OH |
| A�� | ���Ƶ��γɹ��̣� | B�� | CCl4�� | ||
| C�� | ������N��N�� | D�� | ������̼�� |
| A�� | CH4 | B�� | C2H6 | C�� | C3H6 | D�� | C3H8 |
| A�� | �� | B�� | �� | C�� | �� | D�� | �� |
��1���û�ѧ����ʽ��ʾSO2�γ�����������ķ�Ӧ��SO2+H2O?H2SO3��2H2SO3+O2=2H2SO4��
��2�����Ƽ�ѭ�����У�Na2SO3��Һ��Ϊ����Һ������NaOH��Һ����SO2�Ƶã��÷�Ӧ�����ӷ���ʽ��2OH-+SO2=SO32-+H2O��
��3������Һ����SO2�Ĺ����У�pH��n��SO32-����n��HSO3-���仯��ϵ���±���
| n��SO32-����n��HSO3-�� | 91��9 | 1��1 | 1��91 |
| pH | 8.2 | 7.2 | 6.2 |
�ڵ�����Һ������ʱ����Һ������Ũ�ȹ�ϵ��ȷ����ab
a��c��Na+���T2c��SO32-��+c��HSO3-��
b��c��Na+����c��HSO3-����c��SO32-����c��H +���Tc��OH-��
c��c��Na+��+c��H +���Tc��SO32-��+c��HSO3-��+c��OH-��
��4��������Һ��pH����ԼΪ6ʱ��������������������ʾ��ͼ���£�

��HSO3-�������ŵ�ĵ缫��Ӧʽ��HSO3-+H2O-2e-=SO42-+3H+��
�ڵ�����������ҺpH����8����ʱ������Һ������ѭ�����ã���������ԭ�����������������õ���������������Һ��������Ũ�Ƚ��ͣ���ʹHSO3-��������SO32-���������ӽ��������ң�����Һ�Ϳ���������
| A�� | HNO3��Ba��NO3��2��NH4NO3��AgNO3 | B�� | HNO3��NH4NO3��Ba��NO3��2��AgNO3 | ||
| C�� | NH4NO3��HNO3��Ba��NO3��2��AgNO3 | D�� | NH4NO3��HNO3��AgNO3��Ba��NO3��2 |