题目内容
9.氯是重要的化工原料,PCl3、PCl5是有机合成中重要的催化剂.(1)已知乙酸在单质磷的催化下,氯气能取代烃基上的一个氯原子,其催化反应过程分为如下两个步骤,请填写空白处:3Cl2+2P═2PCl3,2PCl3+3CH3COOH=3CH2ClCOOH+3HCl+2P.
(2)已知2P(s)+3Cl2(g)═2PCl3(g)△H=-612kJ•mol-1
PCl3(g)+Cl2(g)═PCl5△H=-99kJ•mol-1
①PCl3(g)分解为两种单质时的热化学方程式2PCl3(g)=2P(s)+3Cl2(g)△H=+810kJ•mol-1;
②将9.3g固体单质磷于VL(标准状况)氯气混合充分反应后放出的热量为101.7kJ,则V=12.32L.
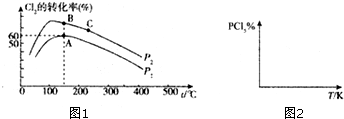
(3)某科技小组对PCl3于Cl2间的反应进行了探究,将2molPCl3、2molCl2分别置于多个容积为2L的密闭容器中,然后在不同温度和压强下反应生成PCl5,反应一段时间后,测得Cl2的转化率如图1所示.
①某容器内反应到A点所用时间为30 min,则此段时间内 v(PCl3)=0.6mol/L.计算A点时该反应的平衡常数k=3.75;
②P1<P2(用“>”、“<”、“=”表示,后同),假设A、B、C 点对应于该反平衡状态.则对应的平衡常数KA,KB和KC相对大小关系为KA=KB>KC.
③写出一种能提高PCl3转化率的方法适当降低温度、分离出PCl3、增大压强或增加氯气浓度均可提高PCl3的转化率.
④请在如图绘制体系中PCl3的百分量随反应温度(T)变化的图象(画出大概趋势即可)
分析 (1)因为磷是催化剂,故第二个步骤应有单质磷生成,故反应物是乙酸与PCl3,对应方程式为2PCl3+3CH3COOH=3CH2ClCOOH+3HCl+2P;
(2)①用前一个方程式与后一个方程式的两倍相加可得到2P(S)+3Cl2=2PCl3(g)△H=-810kJ•mol-1,2PCl3(g)=2P(s)+3Cl2(g)△H=+810kJ•mol-1,;
②设生成PCl3的单质磷为xmol,生成PCl5的单质磷为ymol,则x-y=0.3,306x-405y=101.7,解得x=0.2mol,y=0.1mol,故V=22.4×(0.3-0.25)=12.32L;
(3)①A点为平衡点,30min时消耗的n(Cl2)=2×0.6mol=1.2mol,v(PCl3)=1.2mol÷2L÷30min=0.02mol/(L.min).平衡时c(PCl3)=c(Cl2)=0.4mol/L,c(PCl5)=0.6mol/L,k=$\frac{c(PC{l}_{5})}{c(PC{l}_{3})•c(C{l}_{2})}$;
②因PCl3(g)+Cl2(g)=PCl5(g)是一个气体分子数目减小的反应,其它条件相同时,压强越大,Cl2的转化率越大,故P2>P1;又因为K的相对大小只与温度有关,又放热反应的温度越高,k值越小,故由KA=KB>KC;
③适当降低温度、分离出PCl3、增大压强或增加氯气浓度均可提高PCl3的转化率;
④起始加入PCl3和Cl2,随着温度升高,PCl3生成速度加快,百分含量增加,当达到一定温度,继续升温,由于该反应为放热反应,平衡逆向移动,百分含量下降.
解答 解:(1)因为磷是催化剂,故第二个步骤应有单质磷生成,故反应物是乙酸与PCl3,对应方程式为2PCl3+3CH3COOH=3CH2ClCOOH+3HCl+2P,故答案为:2PCl3+3CH3COOH=3CH2ClCOOH+3HCl+2P;
(2)①用前一个方程式与后一个方程式的两倍相加可得到2P(S)+3Cl2=2PCl3(g)△H=-810kJ•mol-1,2PCl3(g)=2P(s)+3Cl2(g)△H=+810kJ•mol-1,故答案为:2PCl3(g)=2P(s)+3Cl2(g)△H=+810kJ•mol-1;
②设生成PCl3的单质磷为xmol,生成PCl5的单质磷为ymol,则x-y=0.3,306x-405y=101.7,解得x=0.2mol,y=0.1mol,故V=22.4×(0.3-0.25)=12.32L,故答案为:12.32L;
A点为平衡点,30min时消耗的n(Cl2)=2×0.6mol=1.2mol,v(PCl3)=1.2mol÷2L÷30min=0.02mol/(L.min).平衡时c(PCl3)=c(Cl2)=0.4moL/L,c(PCl3)=0.6mol/L,k=$\frac{c(PC{l}_{5})}{c(PC{l}_{3})•c(C{l}_{2})}$=$\frac{0.6mol/L}{0.4mol/L×0.4mol/L}$=3.75;
,故答案为:0.6mol/L;3.75;
②因PCl3(g)+Cl2(g)=PCl5(g)是一个气体分子数目减小的反应,其它条件相同时,压强越大,Cl2的转化率越大,故P2>P1;又因为K的相对大小只与温度有关,又放热反应的温度越高,k值越小,故由KA=KB>KC,故答案为:<;KA=KB>KC;
③适当降低温度、分离出PCl3、增大压强或增加氯气浓度均可提高PCl3的转化率,故答案为:适当降低温度、分离出PCl3、增大压强或增加氯气浓度均可提高PCl3的转化率;
④起始加入PCl3和Cl2,随着温度升高,PCl3生成速度加快,百分含量增加,当达到一定温度,继续升温,由于该反应为放热反应,平衡逆向移动,百分含量下降,故答案为 .
.
点评 本题考查了盖斯定律、化学反应速率的计算、化学平衡常数的计算、化学平衡的影响因素,题目难度中等,注意掌握化学反应速率的表达式及计算方法,明确化学平衡常数的概念及计算方法.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 在中和滴定实验中,锥形瓶用蒸馏水洗净后即可使用,滴定管用蒸馏水洗净后,须经干燥或润洗后方可使用 | |
| B. | 用碱式滴定管量取25.00mL高锰酸钾溶液 | |
| C. | 向冰醋酸中加水至配成醋酸稀溶液的过程中H+的浓度逐渐减小 | |
| D. | 25℃时NH4Cl溶液的KW大于100℃时NaCl溶液的KW |
| A. | 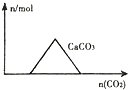 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 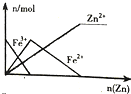 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. | 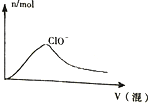 HCl与Cl2的混合通入NaOH溶液中 |
已知:
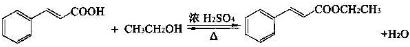
| 名称 | 相对分子质量 | 原色,状态 | 沸点(℃) | 密度(g•cm-3) |
| 肉桂酸 | 148 | 白色晶体 | 300 | 1.2475 |
| 肉桂酸乙酯 | 176 | 无色油状液体 | 271.5 | 1.0491 |
| 乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
| 环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
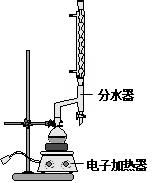
①在圆底烧瓶中加入14.80g肉桂酸,25mL95%的乙醇,20mL环己烷和4mL浓硫酸,混合均匀并加入沙粒,加热回流2h,至分水器中水层不再明显增加,停止加热,冷却至室温.
②将烧瓶内反应液倒入盛有适量水的烧杯中,加入Na2CO3,用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并至有机层,加入少量无水MgSO4固体,静置,过滤,对滤液进行蒸馏,低温蒸出乙醇、乙醚和环已烷后,继续升温,接收271~273℃的馏分.
③检验合格后,测得产品质量为13.60g.
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最合适的是C(填入正确选项前的字母)
A.25mL B.50mL C.100mL D.250mL
(2)步骤①中控制加热回流温度的范围A(填入正确选项前的字母)
A.65~70℃B.78.3~80.8℃C.80.8~271.5℃D.271.5~300℃
(3)步骤②中加入NaCO3的作用是除去过量的硫酸和肉桂酸,加入无水MgSO4固体的作用是除去产品中微量的水.
(4)关于该实验的操作叙述正确的是B.
A.冷凝管中的冷却水从上口进下口出,与管内蒸气形成逆流
B.使用分水器时,先加水接近支管口,随着加热回流,及时打开活塞放出少量的水
C.萃取操作时,振荡过程中需要放气,放气是通过打开分液漏斗上口的玻璃塞进行的
D.静置分层后,打开活塞,先放出有机层,再弃去水层
(5)检验产品中是否含有肉桂酸的方法取少量粗产品固体溶于水,测溶于的pH.
(6)计算肉桂酸乙酯的产率77.27%.
| A. | 加热后固体发黑 | B. | 坩埚沾有受热不分解的杂质 | ||
| C. | 加热时有少量晶体溅出 | D. | 晶体中混有受热不分解的杂质 |
| A. | 标准状况下,2.24L戊烷中存在的共价键总数为1.6NA | |
| B. | 23gNO2与N2O4的混合气体中含有的氮原子数为0.5NA | |
| C. | 过氧化钠与二氧化碳反应时,生成0.1mol氧气转移的电子数为0.4NA | |
| D. | 1L0.1mol•L-1的NaH2PO4溶液中H2PO4-、HPO42-和PO43-离子数之和为0.1NA |

 .
.
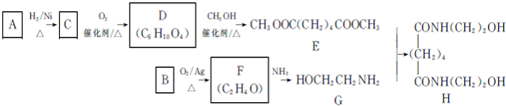
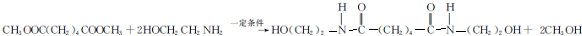 .
.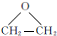 ,能发生银镜反应的F的同分异构体是CH3CHO.
,能发生银镜反应的F的同分异构体是CH3CHO.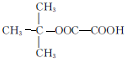 (写结构简式).
(写结构简式).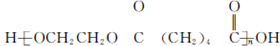 的合成路线:
的合成路线: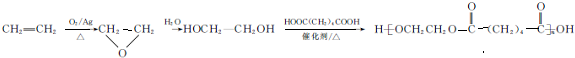 .
.