��Ŀ����
18��þ���仯�����й㷺��;�� ��ҵ������þ����Ҫ�ɷ�Ϊ MgCO3���� SiO2�Լ�����FeCO3�����ʣ�Ϊԭ���Ʊ���������þ��ʵ���������£�
�ش��������⣺
��1������1ΪSiO2���ѧʽ����CO�� NH2 ��2�ĵ���ʽΪ
 ��
����2������ H2O2��������Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+=2Fe3++2H2O��
��3 ����ʵ������������2�ƵõĽ���������ΪFe2O3���ѧʽ������Ҫ���������ƾ��ơ����żܡ����������⣬����Ҫb�����ţ���
a���ձ� b������ c���Թ� d��������
��4����һ�������� CO�� NH2 �� 2���� H2O��Ӧ���� CO2�����һ�������Ӧ�Ļ�ѧ����ʽΪCO��NH2��2+3H2O=CO2��+2NH3•H2O��
��5������ʱ������ CO��NH2��2�������������� Mg2+������ȫʱ����Һ�е� c��OH-��=1.4��10-3 mol•L-1������Ũ��С��1.0��10-5 mol•L-1ʱ��������Ϊ�����ӳ�����ȫ������ʱ��Ksp[Mg��OH��2]=1.96��10-11����
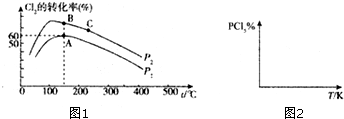
�� 6����ҵ�ϻ������Ȼ�þ��̼���Ϊԭ�ϣ�����ֱ�ӳ������Ʊ����� MgO����ͼΪ��Ӧ�¶ȶ����� MgO���ʺ�������Ӱ�죬��ͼ������Ӧ������¶�Ϊ50�森

���� ��������Ҫ�ɷ�ΪMgCO3��������FeCO3��SiO2������ϡ�������ܣ��������費��Ӧ�����˷��룬����1ΪSiO2�����˵õ���Һ�к�������þ������������δ��Ӧ�����ᣬ��Һ�м���������⣬��Fe2+����ΪFe3+�������һˮ�ϰ�������ҺpH��ʹFe3+ת��ΪFe��OH��3���������˳�ȥ����Һ�к�������þ������淋ȣ�����CO��NH2��2ʼ��������������PVA���з�ɢ�����˸���õ�������þ���������������Ʊ���������þ��
��1���������費�����ᷴӦ��CO�� NH2 ��2��Cԭ����O��֮���γ�2�Թ��õ��Ӷԣ�Nԭ����Cԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ�
��2�����������£�H2O2��Fe2+����ΪFe3+��
��3������2Ϊ���������������������շֽ����ɵ������������չ�����Ҫ�������н��У�
��4����һ��������CO��NH2��2����H2O��Ӧ����CO2��һ���������ԭ���غ��֪����Ϊһˮ�ϰ���
��5��Ksp[Mg��OH��2]=c��Mg2+����c2��OH-��=1.96��10-11���㣻
��6��ѡ����ʸߡ�����С���¶ȣ�
��� �⣺��������Ҫ�ɷ�ΪMgCO3��������FeCO3��SiO2������ϡ�������ܣ��������費��Ӧ�����˷��룬����1ΪSiO2�����˵õ���Һ�к�������þ������������δ��Ӧ�����ᣬ��Һ�м���������⣬��Fe2+����ΪFe3+�������һˮ�ϰ�������ҺpH��ʹFe3+ת��ΪFe��OH��3���������˳�ȥ����Һ�к�������þ������淋ȣ�����CO��NH2��2ʼ��������������PVA���з�ɢ�����˸���õ�������þ���������������Ʊ���������þ��
��1���������費�����ᷴӦ������1ΪSiO2��CO�� NH2 ��2��Cԭ����O��֮���γ�2�Թ��õ��Ӷԣ�Nԭ����Cԭ��֮���γ�1�Թ��õ��Ӷԣ�Nԭ����Hԭ��֮���γ�1�Թ��õ��Ӷԣ�����ʽΪ�� ��
��
�ʴ�Ϊ��SiO2�� ��
��
��2�����������£�H2O2��Fe2+����ΪFe3+����Ӧ�����ӷ���ʽΪ��2Fe2++H2O2+2H+=2Fe3++2H2O��
�ʴ�Ϊ��2Fe2++H2O2+2H+=2Fe3++2H2O��
��3������2Ϊ���������ƣ��������������ֽ����ɵ�����������ѧʽΪFe2O3�����չ�����Ҫ�����������գ�
�ʴ�Ϊ��Fe2O3��b��
��4����һ��������CO��NH2��2����H2O��Ӧ����CO2��һ���������ԭ���غ��֪����Ϊһˮ�ϰ�����Ӧ�Ļ�ѧ����ʽΪ��CO��NH2��2+3H2O=CO2��+2NH3•H2O��
�ʴ�Ϊ��CO��NH2��2+3H2O=CO2��+2NH3•H2O��
��5���� Mg2+������ȫʱ����Һ��c��Mg2+��=1.0��10-5 mol•L-1��Ksp[Mg��OH��2]=c��Mg2+����c2��OH-��=1.96��10-11����֪c��OH-��=1.4��10-3 mol•L-1��
�ʴ�Ϊ��1.4��10-3 mol•L-1��
��6��ͼ1Ϊ��Ӧ�¶ȶ�����MgO���ʺ�������Ӱ�죬50��ʱ����þ�������������С���¶��ٸߣ����ʼ�С�������仯���ʷ�Ӧ������¶�Ϊ50�棬
�ʴ�Ϊ��50�森
���� ���⿼���������������̣��漰�����Ŀ�����ѡ�Բ����ķ������ۡ��ܶȻ��йؼ���ȣ�ע������Ԫ�ػ��������ʣ��Ƕ�ѧ���ۺ������Ŀ��飬�Ǹ߿��������ͣ�

| A�� | ��ʽ�ζ�����װ��Һǰ�ñ�������Һ��ϴ2��3�� | |
| B�� | ��ʼʵ��ʱ��ʽ�ζ��ܼ��첿�������ݣ��ڵζ�������������ʧ | |
| C�� | ��ʽ�ζ��ܶ���ʱ���ζ�ǰ��ȷ�������ζ����Ӷ��� | |
| D�� | ʢNaOH��Һ����ƿ�ζ�ǰδ�������ˮ�� |
| A�� | 1 mo1•L-1�� Ca��ClO��2��Һ�к�ClO-��ĿС��2NA | |
| B�� | 1 mo1 N2��3 mol H2���ܱ������г�ַ�Ӧ�������к��� N-H����Ϊ6NA | |
| C�� | 1 mol��ϩ���Ҵ�����Ļ������ȫȼ�գ����ĵ���������Ϊ3NA | |
| D�� | ��״���£�2.24 L35Cl2�к��е�������Ϊ3.4NA |
| A�� | KCl��NaCl��BaO��CaO | B�� | NaCl��KCl��CaO��BaO | ||
| C�� | CaO��BaO��KCl��NaCl | D�� | CaO��BaO��NaCl��KCl |

 �����¶ȹ���ʱ��β�����ж�����ĺ��������ߣ�ԭ����CO2+C$\frac{\underline{\;����\;}}{\;}$2CO���û�ѧ����ʽ��ʾ����
�����¶ȹ���ʱ��β�����ж�����ĺ��������ߣ�ԭ����CO2+C$\frac{\underline{\;����\;}}{\;}$2CO���û�ѧ����ʽ��ʾ���� ����ʽΪCmH20��������mΪ9�������к���22�����ۼ��������ķ���ʽ��C7H16����CO2���ܶȣ�ͬ��ͬѹ����ͬ����������ʽΪ��C3H8����������������Ϊ1mol��������O2��ȼ�գ�����O2�����ǣ������ʽ��C9H20��
����ʽΪCmH20��������mΪ9�������к���22�����ۼ��������ķ���ʽ��C7H16����CO2���ܶȣ�ͬ��ͬѹ����ͬ����������ʽΪ��C3H8����������������Ϊ1mol��������O2��ȼ�գ�����O2�����ǣ������ʽ��C9H20��
 ��
�� ��
�� �����й���X��˵������ȷ����bc������ĸ����
�����й���X��˵������ȷ����bc������ĸ���� ��
�� ����ṹ��ʽ����
����ṹ��ʽ����