题目内容
20.下列图象正确的是( )| A. | 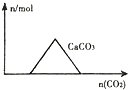 向Ca(OH)2和NaOH的混合溶液中通入CO2 | |
| B. | 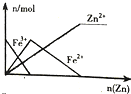 向FeCl3溶液中加入锌粉 | |
| C. |  向NaOH溶液中通入CO2 | |
| D. | 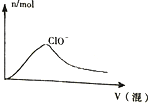 HCl与Cl2的混合通入NaOH溶液中 |
分析 A、Ca(OH)2和NaOH的混合溶液中通入CO2,二氧化碳先与氢氧化钙反应产生白色沉淀,后与氢氧化钠反应,最后碳酸根与过量的二氧化碳反应使沉淀溶解;
B、向FeCl3溶液中加入锌粉,发生反应2Fe3++Zn=2Fe2++Zn2+,Zn+Fe2+=Fe+Zn2+,故三价铁一直减少,二价铁先增加后减少直至为0,锌离子慢慢增加最后不变;
C、向NaOH溶液中通入CO2,2OH-+CO2=CO32-+H2O,CO32-+CO2+H2O=2HCO3-,根据比例关系分析;
D、HCl与Cl2的混合通入NaOH溶液中氢氧化钠先与盐酸反应,故开始不可能有次氯酸跟离子产生.
解答 解:A、Ca(OH)2和NaOH的混合溶液中通入CO2,二氧化碳先与氢氧化钙反应产生白色沉淀,后与氢氧化钠反应,最后碳酸根与过量的二氧化碳反应使沉淀溶解,故A错误;
B、向FeCl3溶液中加入锌粉,发生反应2Fe3++Zn=2Fe2++Zn2+,Zn+Fe2+=Fe+Zn2+,故三价铁一直减少,二价铁先增加后减少直至为0,锌离子慢慢增加最后不变,故B正确;
C、向NaOH溶液中通入CO2,2OH-+CO2=CO32-+H2O,CO32-+CO2+H2O=2HCO3-,根据比例关系,氢氧根是碳酸根离子量的2倍,故C错误;
D、HCl与Cl2的混合通入NaOH溶液中氢氧化钠先与盐酸反应,故开始不可能有次氯酸跟离子产生,故D错误.
故选B.
点评 本题考查了离子方程式的定性与定量分析,结合图象分析物质间反应的比例关系与产生的关系,要求学生熟练掌握反应原理,试题难度中等.

练习册系列答案
相关题目
8.下列各项中表达正确的是( )
| A. | H、D、T表示同一种核素 | B. | F-离子结构示意图 | ||
| C. | 次氯酸电子式 | D. | 用电子式表示HCl形成过程 |
8.实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏高的是( )
| A. | 酸式滴定管在装酸液前用标准盐酸溶液润洗2~3次 | |
| B. | 开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 | |
| C. | 酸式滴定管读数时,滴定前正确读数,滴定后俯视读数 | |
| D. | 盛NaOH溶液的锥形瓶滴定前未干燥,带有水珠 |
15.电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,有关反应方程式为2FeCl3+Cu=2FeCl2+CuCl2.
现将一块敷有铜箔的绝缘板浸入8.00×102mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀.计算:
(1)溶液A中FeCl3的物质的量浓度为3.00mol/L;
(2)假设铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于67.2g;
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填写下表相关栏目.
(4)当m=100.0,n=96.8时,溶液B中FeCl2的物质的量浓度为2.50 mol•L-1.
现将一块敷有铜箔的绝缘板浸入8.00×102mL 某FeCl3溶液A中,一段时间后,将该线路板取出,向所得溶液B中加入铁粉m g,充分反应后剩余固体n g;将固体滤出并从滤液C(忽略反应前后溶液体积的变化)中取出20.00mL,向其中滴入3.00mol•L-1AgNO3溶液60.00mL时,溶液中的Cl-恰好完全沉淀.计算:
(1)溶液A中FeCl3的物质的量浓度为3.00mol/L;
(2)假设铁粉不再溶解,向溶液B中加入的铁粉质量至少应当大于67.2g;
(3)讨论当剩余固体的组成不同时,m与n可能的取值范围,并填写下表相关栏目.
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
12.某同学用中和滴定法测定某烧碱样品的纯度,实验步骤如下:
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
Ⅰ、配制待测液:用托盘天平称量5.00g烧碱样品(杂质不与盐酸反应),配成1000mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.1mol.L-1的盐酸标准溶液进行滴定,达到滴定终点后,重复此操作两次;
Ⅲ、记录数据如下表:
根据上述实验回答以下问题:
(1)配制待测液时,除烧杯、玻璃杯、胶头滴管外,还需要的主要玻璃仪器有1000mL容量瓶
(2)盛装0.1mol.L-1的盐酸标准溶液应该使用酸式滴定管,滴定时眼睛应注意观察:锥形瓶中溶液颜色的变
(3)滴定时如果用甲基橙做指示剂,达到滴定的标志是溶液由黄色变为橙色,且半分钟不变色
(4)下列操作会造成测定结果偏高的是B(填字母序号)
A.用蒸馏水冲洗锥形瓶;
B.在滴定过程中不慎将数滴酸液滴在锥形瓶外;
C.读数时,滴定前仰视,滴定后俯视.
(5)计算烧碱样品的纯度是80.8%.
用中和滴定法测定某烧碱样品的纯度.有以下步骤:
Ⅰ、配制待测液:用托盘天平称量5.00g烧碱样品(杂质不与盐酸反应),配成1000mL溶液;
Ⅱ、滴定:取20.00mL所配待测液,用0.1mol.L-1的盐酸标准溶液进行滴定,达到滴定终点后,重复此操作两次;
Ⅲ、记录数据如下表:
| 测定序号 | 待测溶液体积 (mL) | 所耗盐酸标准溶液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.78 |
| 2 | 20.00 | 1.2 | 21.32 |
| 3 | 20.00 | 1.3 | 21.50 |
(1)配制待测液时,除烧杯、玻璃杯、胶头滴管外,还需要的主要玻璃仪器有1000mL容量瓶
(2)盛装0.1mol.L-1的盐酸标准溶液应该使用酸式滴定管,滴定时眼睛应注意观察:锥形瓶中溶液颜色的变
(3)滴定时如果用甲基橙做指示剂,达到滴定的标志是溶液由黄色变为橙色,且半分钟不变色
(4)下列操作会造成测定结果偏高的是B(填字母序号)
A.用蒸馏水冲洗锥形瓶;
B.在滴定过程中不慎将数滴酸液滴在锥形瓶外;
C.读数时,滴定前仰视,滴定后俯视.
(5)计算烧碱样品的纯度是80.8%.
10.离子晶体熔点的高低决定于阴、阳离子之间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
| A. | KCl>NaCl>BaO>CaO | B. | NaCl>KCl>CaO>BaO | ||
| C. | CaO>BaO>KCl>NaCl | D. | CaO>BaO>NaCl>KCl |
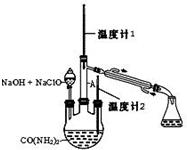 水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应:
水合肼 (N2H4•H2O) 常用作还原剂和抗氧剂,其熔点为-40℃,沸点 118.5℃,极毒.实验室用如下装置制取水合肼(N2H4•H2O)涉及下列反应: