题目内容
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |
考点:镁、铝的重要化合物,金属的电化学腐蚀与防护,二氧化硫的化学性质,硅和二氧化硅
专题:化学应用
分析:A.耐高温材料应具有高熔点的性质;
B.二氧化硅与氢氟酸反应;
C.二氧化硫通入品红溶液后溶液呈无色,加热时恢复原状;
D.锌活泼性强于铁,形成原电池时,锌做负极失电子被氧化,铁做正极被保护.
B.二氧化硅与氢氟酸反应;
C.二氧化硫通入品红溶液后溶液呈无色,加热时恢复原状;
D.锌活泼性强于铁,形成原电池时,锌做负极失电子被氧化,铁做正极被保护.
解答:
解:A.耐高温材料应具有高熔点的性质,因氧化镁和氧化铝熔点很高,可用作耐高温材料,如耐高温陶瓷等,故A正确;
B.二氧化硅与氢氟酸常温发生反应,不能用玻璃瓶盛放氢氟酸,故B错误;
C.二氧化硫通入品红溶液后溶液呈无色,加热时恢复原状,所以加热后溶液由无色变为红色,故C错误;
D、锌活泼性强于铁,形成原电池时,锌做负极失电子被氧化,铁做正极被保护;陈述ⅠⅡ都正确且有因果关系,故D正确;
故选AD.
B.二氧化硅与氢氟酸常温发生反应,不能用玻璃瓶盛放氢氟酸,故B错误;
C.二氧化硫通入品红溶液后溶液呈无色,加热时恢复原状,所以加热后溶液由无色变为红色,故C错误;
D、锌活泼性强于铁,形成原电池时,锌做负极失电子被氧化,铁做正极被保护;陈述ⅠⅡ都正确且有因果关系,故D正确;
故选AD.
点评:本题考查了常见物质的性质,属于对基础知识的考查,题目难度不大,结合相关知识即可解答.

练习册系列答案
相关题目
下列说法正确的是:( )
①水分子之间存在氢键,所以水受热不易分解
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔化状态下能导电的物质不一定是离子化合物
⑦有单质生成的反应一定是氧化还原反应
⑧碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物.
①水分子之间存在氢键,所以水受热不易分解
②共价化合物一定含共价键,也可能含离子键
③含金属元素的化合物不一定是离子化合物
④由非金属元素组成的化合物一定是共价化合物
⑤由分子组成的物质中一定存在共价键
⑥熔化状态下能导电的物质不一定是离子化合物
⑦有单质生成的反应一定是氧化还原反应
⑧碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物.
| A、③⑤⑥⑦⑧ | B、②③④⑥⑦ |
| C、③⑥⑧ | D、①③④⑥ |
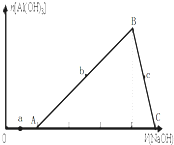 向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )
向盐酸和AlCl3的混合溶液中逐滴加入NaOH溶液至过量,生成沉淀Al(OH)3的量随着加入NaOH溶液体积的变化关系如图所示,下列说法正确的是( )| A、在a点对应的溶液中,加入Mg2+、I-、NH4+、NO3-离子仍能大量共存 |
| B、原溶液中盐酸和AlCl3物质的量的浓度之比为1:3 |
| C、若b、c的纵坐标数值相同,则横坐标数值之比为1:3 |
| D、图中B→C的过程中,实际发生的离子方程式为Al(OH)3+OH-=AlO2-+2H2O |



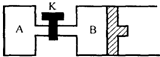 如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.
如图所示,B中活塞可以自由滑动.A、B中均有1mol X、1mol Y,起始时,V(A)=V(B)=a L.关闭K,相同温度下,两容器中同时发生反应:2X(g)+2Y(g)=Z(g)+2W(g)△H<0,达到平衡(Ⅰ)时,V(B)=0.8a L.


