题目内容
在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,氧化产物与还原产物的质量比是 ;若有0.5mol的KClO3参加反应,则转移电子总数为 .
考点:氧化还原反应,氧化还原反应的计算
专题:氧化还原反应专题
分析:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,1molCl得到电子与5molCl失去电子遵循电子守恒,氯气既是氧化产物也是还原产物,结合元素的化合价变化计算转移电子数,以此来解答.
解答:
解:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O中,1molCl得到电子与5molCl失去电子遵循电子守恒,氯气既是氧化产物也是还原产物,失去电子对应氧化产物,得到电子对应还原产物,则氧化产物与还原产物的质量比是5:1;0.5mol的KClO3参加反应,则转移电子总数为0.5mol×(5-0)×NA=2.5NA或1.505×1024,
故答案为:5:1;2.5NA或1.505×1024.
故答案为:5:1;2.5NA或1.505×1024.
点评:本题考查氧化还原反应的计算,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重转移电子计算及分析计算能力的考查,题目难度不大.

练习册系列答案
相关题目
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |
向盛有10mL AlCl3溶液试管,逐渐滴入加NaOH溶液的图象如图,则下列说法不正确的是( )
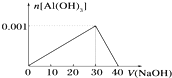

| A、AlCl3溶液的浓度为0.1mol?L-1 |
| B、NaOH溶液的浓度为0.1mol?L-1 |
| C、沉淀最大质量为0.078g |
| D、加入10mL的NaOH溶液与加入38mL的NaOH溶液产生的沉淀质量相同 |
下列物质转化在给定的条件下能实现的是( )
①Al2O3
NaAlO2(aq)
Al(OH)3
②S
SO3
H2SO4
③石油化工采用银作催化剂,可以实现一步完成:2CH2=CH2+O2

④Fe2O3
FeCl3(aq)
无水FeCl3
⑤MgCl2(aq)
Mg(OH)2
MgO
⑥NH3
NO
HNO3.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2/点燃 |
| H2O |
③石油化工采用银作催化剂,可以实现一步完成:2CH2=CH2+O2
| Ag |

④Fe2O3
| HCl(aq) |
| △ |
⑤MgCl2(aq)
| 石灰乳 |
| 煅烧 |
⑥NH3
| O2 |
| O2,H2O |
| A、①②③④ | B、①③④⑥ |
| C、①③⑤⑥ | D、②④⑤⑥ |
含一个叁键的炔烃,氢化后的产物的结构简式CH3CH2CH(CH2CH3)CH2CH(CH3)CH2CH3此炔烃可能的结构有( )
| A、1种 | B、2种 | C、3种 | D、4种 |
下列说法中不正确的是( )
| A、Na2O2可做呼吸面具的供氧剂 |
| B、单质硅是生产光导纤维的基本原料 |
| C、目前世界上使用量最大的合金是钢 |
| D、明矾可作净水剂 |
下列各组有机物中,不论按何种比例混合,只要总质量一定,完全燃烧后,生成水的总质量相同的是( )
| A、甲烷、丙炔 |
| B、甲醛、甲酸 |
| C、乙醇、乙二醇 |
| D、甲苯、甘油 |