题目内容
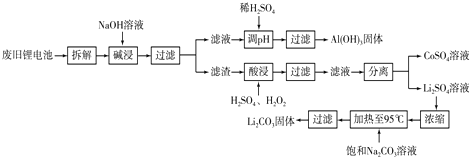
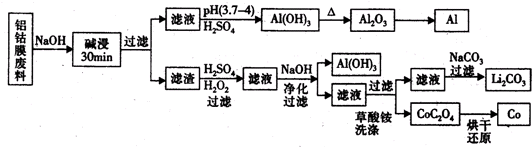
钴是国民经济建设和国防建设不可缺少的重要原料之一,从锂离子二次电池正极(LiCo02)废料--铝钴膜中回收钴的工艺如图所示:
回答下列问题:
(1)写出工业上用Al2O3制取铝的化学方程式
(2)工艺图中加入氢氧化钠净化的目的是
(3)为使钴浸出.需将LiCo02的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式
(4)锂可由电解制得,以石墨为阳极,低碳钢为阴极,电解液为熔融的LiCI和KCI的混合液,电解槽压为6.0-6.5V,这样可得到纯度为99%的锂.
①在电解液中加人KCl的原因
②阴极产物与镁的性质相似,在常温下与氮气反应,请写出其与氮气反应的生成物与水的反应方程式 .
③已知阴极产物在500℃与氢气能反应生成氢化物,请写出该氢化物的电子式
(5)已知钴与铁的性质相似,请写出四氧化三钴与氢碘酸反应的离子方程式 .

回答下列问题:
(1)写出工业上用Al2O3制取铝的化学方程式
(2)工艺图中加入氢氧化钠净化的目的是
(3)为使钴浸出.需将LiCo02的结构破坏,选择在硫酸和双氧水体系中进行浸出,请写出浸出的化学方程式
(4)锂可由电解制得,以石墨为阳极,低碳钢为阴极,电解液为熔融的LiCI和KCI的混合液,电解槽压为6.0-6.5V,这样可得到纯度为99%的锂.
①在电解液中加人KCl的原因
②阴极产物与镁的性质相似,在常温下与氮气反应,请写出其与氮气反应的生成物与水的反应方程式
③已知阴极产物在500℃与氢气能反应生成氢化物,请写出该氢化物的电子式
(5)已知钴与铁的性质相似,请写出四氧化三钴与氢碘酸反应的离子方程式
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:铝钴膜废料的成分为LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀,通过加热得到氧化铝,再通过电解熔融氧化铝获得金属Al;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,溶液中含有杂质铝离子,然后加入氢氧化钠溶液调节溶液pH,生成氢氧化铝沉淀从而除去铝离子,最后对滤液用草酸铵洗涤处理,经过一系列处理得到碳酸锂和金属Co,
(1)工业上通过电解熔融氧化铝的方法获得金属铝,据此写出化学方程式;
(2)用氢氧化钠溶液调节溶液的pH在5.0左右,可以将铝离子转化成氢氧化铝沉淀而除去;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;
(4)①电解熔融氯化锂获得锂时,加入氯化钾可以增强电解液的导电性;
②电解熔融氯化锂过程中,阴极得到的是金属锂,锂与氮气反应生成氮化锂,氮化锂与水反应生成氨气和氢氧化锂;
③锂与氢气反应生成离子化合物氢化锂,根据电子式的书写方法解答;
(5)钴与铁的性质相似,四氧化三钴与四氧化三铁性质相似,类比四氧化三铁与氢碘酸的反应写出四氧化三钴与氢碘酸反应的离子方程式.
(1)工业上通过电解熔融氧化铝的方法获得金属铝,据此写出化学方程式;
(2)用氢氧化钠溶液调节溶液的pH在5.0左右,可以将铝离子转化成氢氧化铝沉淀而除去;
(3)根据所加入的反应物以及生成物结合质量守恒定律来书写化学方程式;
(4)①电解熔融氯化锂获得锂时,加入氯化钾可以增强电解液的导电性;
②电解熔融氯化锂过程中,阴极得到的是金属锂,锂与氮气反应生成氮化锂,氮化锂与水反应生成氨气和氢氧化锂;
③锂与氢气反应生成离子化合物氢化锂,根据电子式的书写方法解答;
(5)钴与铁的性质相似,四氧化三钴与四氧化三铁性质相似,类比四氧化三铁与氢碘酸的反应写出四氧化三钴与氢碘酸反应的离子方程式.
解答:
解:铝钴膜废料的成分为LiCo02和铝箔,将废料先用碱液浸泡,将Al充分溶解,过滤后得到的滤液为含有偏铝酸钠,滤渣为LiCo02;通过调节滤液的pH,将偏铝酸钠转化成氢氧化铝沉淀,通过加热得到氧化铝,再通过电解熔融氧化铝获得金属Al;将滤渣用双氧水、硫酸处理后生成Li2SO4、CoSO4,溶液中含有杂质铝离子,然后加入氢氧化钠溶液调节溶液pH,生成氢氧化铝沉淀从而除去铝离子,最后对滤液用草酸铵洗涤处理,经过一系列处理得到碳酸锂和金属Co,
(1)电解熔融氧化铝可以获得金属铝和氧气,反应的化学方程式为:2Al2O3
4Al+3O2↑,
故答案为:2Al2O3
4Al+3O2↑;
(2)滤渣用硫酸和双氧水处理后Co元素全部留在滤液中,且滤液中含有杂质铝离子,用氢氧化钠溶液调节pH,可以将杂质铝离子除掉,
故答案为:除去杂质离子(Al3+);
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应的化学方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;
(4)①电解液中加入氯化钾后,可以大大提高电解液的导电性,增强电解效果,
故答案为:增强电解液的导电性;
②电解熔融LiCl过程中,阴极得到的是金属Li,锂与氮气反应生成Li3N,氮化锂与水反应会生成氨气和氢氧化锂,反应的化学方程式为:Li3N+3H2O=NH3↑+3LiOH,
故答案为:Li3N+3H2O=NH3↑+3LiOH;
③电解熔融LiCl过程中,阴极得到的是金属Li,锂与氢气在一定条件下反应生成氢化锂,氢化锂为离子化合物,其电子式为:Li+[:H]-,
故答案为:Li+[:H]-;
(5)已知钴与铁的性质相似,则四氧化三钴与四氧化三铁的化学性质相似,四氧化三铁与碘化氢反应的离子方程式为:2I-+Fe3O4+8H+=3Fe2++4H2O+I2,则四氧化三钴与氢碘酸反应的离子方程式:Co3O4+8H++2I-=3Co2++I2+4H2O,
故答案为:Co3O4+8H++2I-=3Co2++I2+4H2O.
(1)电解熔融氧化铝可以获得金属铝和氧气,反应的化学方程式为:2Al2O3
| ||
故答案为:2Al2O3
| ||
(2)滤渣用硫酸和双氧水处理后Co元素全部留在滤液中,且滤液中含有杂质铝离子,用氢氧化钠溶液调节pH,可以将杂质铝离子除掉,
故答案为:除去杂质离子(Al3+);
(3)酸浸时反应物有硫酸、过氧化氢以及LiCoO2,生成物有Li2SO4和CoSO4,反应的化学方程式为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O,
故答案为:2LiCoO2+H2O2+3H2SO4=Li2SO4+2CoSO4+O2↑+4H2O;
(4)①电解液中加入氯化钾后,可以大大提高电解液的导电性,增强电解效果,
故答案为:增强电解液的导电性;
②电解熔融LiCl过程中,阴极得到的是金属Li,锂与氮气反应生成Li3N,氮化锂与水反应会生成氨气和氢氧化锂,反应的化学方程式为:Li3N+3H2O=NH3↑+3LiOH,
故答案为:Li3N+3H2O=NH3↑+3LiOH;
③电解熔融LiCl过程中,阴极得到的是金属Li,锂与氢气在一定条件下反应生成氢化锂,氢化锂为离子化合物,其电子式为:Li+[:H]-,
故答案为:Li+[:H]-;
(5)已知钴与铁的性质相似,则四氧化三钴与四氧化三铁的化学性质相似,四氧化三铁与碘化氢反应的离子方程式为:2I-+Fe3O4+8H+=3Fe2++4H2O+I2,则四氧化三钴与氢碘酸反应的离子方程式:Co3O4+8H++2I-=3Co2++I2+4H2O,
故答案为:Co3O4+8H++2I-=3Co2++I2+4H2O.
点评:本题为生产流程题,涉及金属的回收、环境保护、氧化还原反应、物质的分离提纯和除杂等问题,题目较为综合,做题时注意仔细审题,从题目中获取关键信息.本题难度中等.

练习册系列答案
相关题目
下列叙述错误的是( )
| A、葡萄糖注射液不能产生丁达尔效应,不属于胶体 |
| B、可用蘸浓盐酸的棉棒检验输送氨气的管道是平否漏气 |
| C、明矾和漂白粉常用于自来水的净化和杀菌流消毒,两者原理相同 |
| D、化学变化中一定有能量变化,而有能量变化过程不一定发生化学反应 |
下列物质的反应过程符合如图所示关系的是( )


| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
已知:H+(aq)+OH- (aq)=H2O(l)△H=-57.3kJ?mol-1,分别向1L0.5moL.L-1的KOH溶液中加入:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应的中和热分别为△H1、△H2、△H3,他们的关系正确的是( )
| A、△H1>△H3>△H2=-57.3 kJ?mol-1 |
| B、△H2<△H1=-57.3 kJ?mol-1<△H3 |
| C、△H1>△H3=-57.3 kJ?mol-1>△H2 |
| D、△H1<△H3=-57.3 kJ?mol-1<△H2 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |