题目内容
电镀铜厂有两种废水,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.某电镀铜厂拟定了如图所示的废水处理流程.
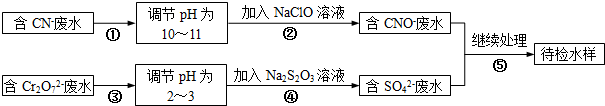
请根据图示回答以下问题:
(1)电镀铜时阳极材料是 ,电极反应式为 .
(2)上述处理废水的流程①~④中涉及到氧化还原反应是(填序号) .
(3)②中使用的NaClO溶液呈碱性,用离子方程式解释原因 .
(4)②中反应后无气体放出,该反应的离子方程式为 .
(5)④中反应时,每0.4mol Cr2O72-转移2.4mol的电子,该反应的离子方程式为 .
(6)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因 .

请根据图示回答以下问题:
(1)电镀铜时阳极材料是
(2)上述处理废水的流程①~④中涉及到氧化还原反应是(填序号)
(3)②中使用的NaClO溶液呈碱性,用离子方程式解释原因
(4)②中反应后无气体放出,该反应的离子方程式为
(5)④中反应时,每0.4mol Cr2O72-转移2.4mol的电子,该反应的离子方程式为
(6)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少,请你使用化学用语,结合必要的文字解释其原因
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:(1)根据电镀原理分析判断;
(2)找出每一个流程发生的反应,根据氧化还原反应一定有元素化合价的变化分析判断;
(3)利用盐的水解来分析盐溶液显碱性的原因;
(4)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(5)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(6)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析.
(2)找出每一个流程发生的反应,根据氧化还原反应一定有元素化合价的变化分析判断;
(3)利用盐的水解来分析盐溶液显碱性的原因;
(4)CN-离子具有还原性、NaClO具有氧化性,利用氧化还原来分析,并注意无气体生成来判断生成物;
(5)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(6)根据铜离子与氢氧根离子反应生成沉淀及沉淀的转化来分析.
解答:
解:(1)电镀时,镀层金属作阳极,待镀金属作阴极,所以阳极材料是纯铜,电极反应式为:Cu-2e-=Cu2+;
故答案为:纯铜; Cu-2e-=Cu2+;
(2)在流程②中发生的化学反应方程式CN-+ClO-═CNO-+Cl-中存在元素化合价的变化,属于氧化还原反应,在流程④中发生的化学反应方程式3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O中S元素由+2价变化到+6价,Cr元素由+6价变化到+3价,属于氧化还原反应;
故答案为:②④;
(3)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为:ClO-+H2O?HClO+OH-;
故答案为:ClO -+H2O?HClO+OH-;
(4)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-=CNO-+Cl-;
(5)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O;
(6)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
故答案为:待检水样中还有Cu2+,Cu2++2OH-=Cu(OH)2↓ Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq),CuS比Cu(OH)2更难溶.
故答案为:纯铜; Cu-2e-=Cu2+;
(2)在流程②中发生的化学反应方程式CN-+ClO-═CNO-+Cl-中存在元素化合价的变化,属于氧化还原反应,在流程④中发生的化学反应方程式3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O中S元素由+2价变化到+6价,Cr元素由+6价变化到+3价,属于氧化还原反应;
故答案为:②④;
(3)NaClO溶液呈碱性,是因次氯酸根离子水解生成氢氧根离子导致的,则离子反应为:ClO-+H2O?HClO+OH-;
故答案为:ClO -+H2O?HClO+OH-;
(4)碱性条件下,CN-离子与NaClO发生氧化还原反应,无气体放出,则生成CNO-、Cl-离子,离子反应为CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-=CNO-+Cl-;
(5)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
故答案为:3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O;
(6)待检水样中还有Cu2+,加碱发生Cu2++2OH-═Cu(OH)2↓,再加入Na2S溶液,CuS比Cu(OH)2更难溶,则发生Cu(OH)2(s)+S2-(aq)═CuS(s)+2OH-(aq).
故答案为:待检水样中还有Cu2+,Cu2++2OH-=Cu(OH)2↓ Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq),CuS比Cu(OH)2更难溶.
点评:本题考查了电解原理、氧化还原反应,注重了化学与实际生产的联系,学生应学会利用物质的性质、元素的化合价、电子守恒等来解答.

练习册系列答案
相关题目
下列物质的反应过程符合如图所示关系的是( )


| A、向CaCl2溶液中通入CO2至过量 |
| B、向澄清石灰水中通入CO2至过量 |
| C、向Na2SiO3溶液中通入CO2至过量 |
| D、AlCl3溶液滴加NaOH溶液至过量 |
已知:H+(aq)+OH- (aq)=H2O(l)△H=-57.3kJ?mol-1,分别向1L0.5moL.L-1的KOH溶液中加入:①稀醋酸 ②浓硫酸 ③稀硝酸,恰好完全反应的中和热分别为△H1、△H2、△H3,他们的关系正确的是( )
| A、△H1>△H3>△H2=-57.3 kJ?mol-1 |
| B、△H2<△H1=-57.3 kJ?mol-1<△H3 |
| C、△H1>△H3=-57.3 kJ?mol-1>△H2 |
| D、△H1<△H3=-57.3 kJ?mol-1<△H2 |
下列有关物质的性质和该性质的应用均正确的是( )
| A、氧化镁、氧化铝的熔点都很高,都可用作耐高温材料 |
| B、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C、品红溶液通入二氧化硫,品红褪色,再加热不恢复红色 |
| D、锌的金属活泼性比铁强,可在海轮外壳上装若干锌块以减缓其腐蚀 |
向盛有10mL AlCl3溶液试管,逐渐滴入加NaOH溶液的图象如图,则下列说法不正确的是( )
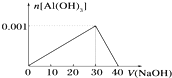

| A、AlCl3溶液的浓度为0.1mol?L-1 |
| B、NaOH溶液的浓度为0.1mol?L-1 |
| C、沉淀最大质量为0.078g |
| D、加入10mL的NaOH溶液与加入38mL的NaOH溶液产生的沉淀质量相同 |