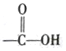
题目内容
16.下列现象与氢键无关的是( )| A. | HF的熔、沸点比ⅦA族其他元素氢化物的高 | |
| B. | 水分子高温下也很稳定 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | NH3极易溶于水 |
分析 A.ⅦA族中,F的非金属性最强,HF中分子之间存在氢键;
B.稳定性与化学键有关;
C.冰中存在氢键,其体积变大;
D.NH3与水分子之间能形成氢键.
解答 解:A.因第ⅦA族中,F的非金属性最强,HF中分子之间存在氢键,则HF的熔、沸点比ⅦA族其他元素氢化物的高,故A正确;
B.水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故B选;
C.冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故C不选;
D.NH3与水分子之间能形成氢键,则NH3易溶于水,故D不选;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
11.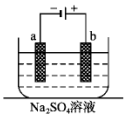 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
 如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )
如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊溶液.下列实验现象中错误的是( )| A. | 电子的流向:负极→a电极→b电极→正极 | |
| B. | a电极附近呈蓝色,b电极附近呈红色 | |
| C. | 逸出气体的体积,a电极的大于b电极的 | |
| D. | Na+向a极移动 |
7.现有8种元素的性质、数据如下表所列,它们属于第二或第三周期.
回答下列问题:
(1)③的元素符号是Li;⑧的元素名称是硼;①在元素周期表中的位置是(周期、族)第二周期第VIA族;其氢化物的电子式是: .
.
(2)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(3)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
| 编号 元素 性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
(1)③的元素符号是Li;⑧的元素名称是硼;①在元素周期表中的位置是(周期、族)第二周期第VIA族;其氢化物的电子式是:
 .
.(2)比较④和⑦的氢化物的稳定性(用化学式表示)NH3>PH3.
(3)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:NH3+HNO3=NH4NO3.
4.下列试剂中,标签上应标注如图标志的是( )


| A. | 汽油 | B. | 浓硫酸 | C. | 高锰酸钾 | D. | 酒精 |
1.某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如图装置(含试剂)进行实验.
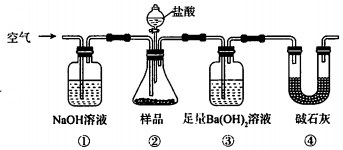
下列说法不正确的是( )

下列说法不正确的是( )
| A. | 必须在②③间添加吸收HCl的装置 | |
| B. | ④的作用是防止空气中的气体影响实验的精确度 | |
| C. | 通入空气的作用是保证②中产生的气体完全转移到③中 | |
| D. | 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度 |
8.某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4•7H2O),设计了如图流程:下列说法不正确的是( )
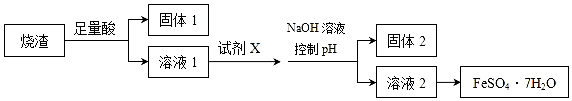

| A. | 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存 | |
| B. | 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成 | |
| C. | 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O | |
| D. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 |
5.新制氯水中存在平衡:Cl2+H2O?HCl+HClO若向氯水中投入少量CaCO3粉末,则( )
| A. | 平衡不移动 | |
| B. | 平衡向正反应方向移动,Cl2的转化率增大 | |
| C. | 平衡移动,且HClO浓度减小 | |
| D. | 平衡移动,且HClO浓度增大 |
6.下列叙述中正确的是( )
| A. | 除零族元素外,短周期元素的最高化合价在数值上等于该元素所属的族序数 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | 除短周期外,其他周期均有18种元素 | |
| D. | X2+的核外电子数目为18,则X在第三周期第ⅡA族 |
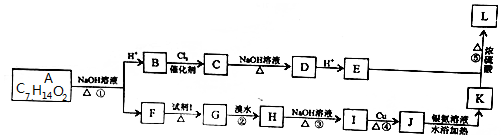
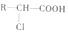
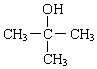 、
、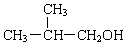 .
.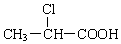 +2 NaOH$→_{△}^{水}$
+2 NaOH$→_{△}^{水}$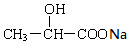 +NaOH+H2O.
+NaOH+H2O.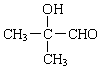 +2 Ag(NH3)2OH$\stackrel{△}{→}$
+2 Ag(NH3)2OH$\stackrel{△}{→}$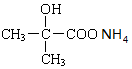 +2 Ag↓+3NH3+H2O.
+2 Ag↓+3NH3+H2O.