题目内容
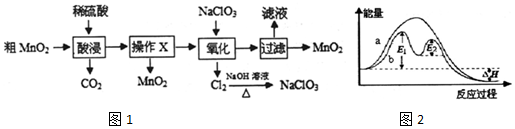
1.某同学为测定Na2CO3固体(含少量NaCl)的纯度,设计如图装置(含试剂)进行实验.
下列说法不正确的是( )
| A. | 必须在②③间添加吸收HCl的装置 | |
| B. | ④的作用是防止空气中的气体影响实验的精确度 | |
| C. | 通入空气的作用是保证②中产生的气体完全转移到③中 | |
| D. | 称取样品和③中产生的沉淀的质量即可求算Na2CO3固体的纯度 |
分析 测定Na2CO3固体(含少量NaCl)的纯度,用应先通入空气,氢氧化钠溶液用于除去空气中的二氧化碳,盐酸和样品反应生成二氧化碳,氢氧化钡与二氧化碳反应生成碳酸钡沉淀,根据沉淀的质量可确定二氧化碳的质量,进而计算碳酸钠的质量,可计算样品的含量,装置中碱石灰可用于吸收空气中的二氧化碳,减少实验误差,以此解答该题.
解答 解:A.氢氧化钡足量,可与氯化氢反应,同时吸收二氧化碳,无需单独添加吸收HCl的装置,故A错误;
B.碱石灰可与二氧化碳反应,可防止空气中的气体影响实验的精确度,故B正确;
C.通入空气,可将生成的二氧化碳完全转移到③中,以被充分吸收,减小实验误差,故C正确;
D.③中产生的沉淀为碳酸钡,根据碳酸钡的质量可计算样品中的碳酸钠,可计算样品含量,故D正确.
故选A.
点评 本题考查物质的含量的测定,为高频考点,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的原理,把握操作方法,难度不大.

练习册系列答案
相关题目
12.下列各有机物的名称肯定错误的是( )
| A. | 3-甲基-2-戊烯 | B. | 2-甲基-3-丁醇 | ||
| C. | 3,3,4-三甲基庚烷 | D. | 2,4,6-三硝基甲苯 |
9. 如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )
如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )
 如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )
如图X为电源,椭圆形滤纸Y浸透饱和食盐水和酚酞试液,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑向c端扩散.下列判断正确的是( )| A. | b为电源的正极,d点周围变红 | B. | Cu电极质量减小,Pt电极质量增大 | ||
| C. | Z中溶液的pH先减小,后增大 | D. | 溶液中的SO42-向Pt电极定向移动 |
16.下列现象与氢键无关的是( )
| A. | HF的熔、沸点比ⅦA族其他元素氢化物的高 | |
| B. | 水分子高温下也很稳定 | |
| C. | 冰的密度比液态水的密度小 | |
| D. | NH3极易溶于水 |
13.运用化学反应原理研究NH3的性质具有重要意义.请回答下列问题:
(1)已知:
①NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化生成NO的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+3O2=2N2+6H2O.已知电解质溶液为KOH溶液,则负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如表:
①由上表数据可知该反应的△H< 0 填“>”、“<”或“=”);
②理论上,为了增大平衡时H2的转化率,可采取的措施是AD(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、l mol•L-1,此时刻该反应的V正(N2)=< V逆(N2).(填“>”、“<”或“=”).
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38,Ksp[Al(OH)3]=4.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol•L-1时,可以认为沉淀完全.在含Fe3+、A13+的浓度均为1.05mol•L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数70%.
(1)已知:
①NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H=-1266.5kJ•mol-1
②N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
写出氨高温催化氧化生成NO的热化学方程式4NH3(g)+5O2(g)$\frac{\underline{催化剂}}{△}$4NO(g)+6H2O(g)△H=-905.5KJ/mol.
(2)氨气、空气可以构成燃料电池,其电池反应原理为:4NH3+3O2=2N2+6H2O.已知电解质溶液为KOH溶液,则负极的电极反应式为2NH3+6OH--6e-═N2+6H2O.
(3)合成氨技术的创立开辟了人工固氮的重要途径,其研究来自正确的理论指导,合成氨反应的化学平衡常数K值和温度的关系如表:
| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
②理论上,为了增大平衡时H2的转化率,可采取的措施是AD(选填字母);
A.增大压强 B.使用合适的催化剂 C.升高温度 D.及时分离出产物中的NH3
③400℃时,测得某时刻氨气、氮气、氢气的物质的量浓度分别为3mol•L-1、2mol•L-1、l mol•L-1,此时刻该反应的V正(N2)=< V逆(N2).(填“>”、“<”或“=”).
(4)已知25℃时,Ksp[Fe(OH)3]=1.0×l0-38,Ksp[Al(OH)3]=4.0×l0-34,当溶液中的金属离子浓度小于1.0×10-5mol•L-1时,可以认为沉淀完全.在含Fe3+、A13+的浓度均为1.05mol•L-1的溶液中加入氨水,当Fe3+完全沉淀时,A13+沉淀的百分数70%.
10.短周期元素X、Y、Z、W的原子序数依次增大.X有三种核素,其中两种可用于制造核弹;Z 与W在周期表中同主族,且Y、Z、W三种元素的原子最外层电子数之和为17;X、Y形成的化合物M的水溶液呈碱性.下列叙述错误的是( )
| A. | 原子半径:W>Y>Z>X | |
| B. | 2.24 L(标准状况)M溶于1 L水中,所得溶液的pH约为13 | |
| C. | YZ2能使湿润的淀粉KI试纸变蓝 | |
| D. | Y、W的最髙价氧化物对应的水化物均为强酸 |
11.下列说法错误的是( )
| A. | 氢是原子半径最小的元素 | |
| B. | 氟是非金属性最强的元素 | |
| C. | 硅元素适合作半导体材料 | |
| D. | 稀有气体元素原子的最外层电子数均为8 |
 如图所示,U形管内盛有100mL的溶液,按要求回答下列问题:
如图所示,U形管内盛有100mL的溶液,按要求回答下列问题: