题目内容
10.下列离子方程式中,正确的是( )| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
分析 A.反应生成硫酸亚铁和氢气;
B.一水合氨在离子反应中保留化学式;
C.碳酸钙在离子反应中保留化学式;
D.反应生成氯化铝和水.
解答 解:A.铁与稀硫酸反应的离子反应为Fe+2H+═Fe2++H2↑,故A错误;
B.氯化铝溶液与氨水反应的离子反应为Al3++3NH3.H2O═Al(OH)3↓+3NH4+,故B错误;
C.碳酸钙与稀盐酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故C错误;
D.氢氧化铝与足量盐酸反应的离子反应为Al(OH)3+3H+═Al3++3H2O,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应及分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
1.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中不正确的是( )
| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | Z和Y组成的物质是原子晶体 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
5.如图是利用二氧化硅是制备硅及其化合物的流程,下列说法正确的是( )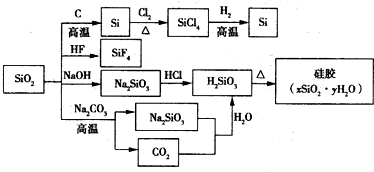

| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用玻璃塞 | |
| C. | 硅胶吸水后可重复再生 | |
| D. | 图中所示转化反应都是氧化还原反应 |
15.如下图所示警示标记中,放浓硫酸的试剂瓶上应印有的( )
| A. |  | B. |  | C. |  | D. |  |
2.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol?L-1,c(Cl-)为1.3mol?L-1.要使Mg2+全部转化为沉淀分离出来,至少需加4mol?L-1NaOH溶液的体积为( )
| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
20.有Fe2+、NO3-、Fe3+、NH4+、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
| A. | 氧化剂与还原剂的物质的量之比为1:8 | |
| B. | 该过程说明Fe(NO3)2溶液不宜加酸酸化 | |
| C. | 若有1 mol NO3-发生氧化反应,则转移8 mol e- | |
| D. | Fe3+的氧化性比HNO3弱 |