题目内容
2.有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol?L-1,c(Cl-)为1.3mol?L-1.要使Mg2+全部转化为沉淀分离出来,至少需加4mol?L-1NaOH溶液的体积为( )| A. | 40mL | B. | 72mL | C. | 80mL | D. | 128mL |
分析 根据电荷守恒计算混合溶液中n(Al3+),向MgCl2和AlCl3的混合溶液加入NaOH溶液,使Mg2+全部转化为沉淀分离出来,Al3+应恰好转化为AlO2-,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=c(Cl-)+n(Al3+),再根据V=$\frac{n}{c}$计算.
解答 解:溶液中n(Cl-)=0.2L×1.3mol/L=0.26mol,
溶液中n(Mg2+)=0.2mol/L×0.2L=0.04mol,
所以溶液中n(Al3+)=$\frac{0.26mol-0.04mol×2}{3}$=0.06mol,
将200mL此溶液中的Mg2+转化为Mg(OH)2沉淀并分离析出,反应后溶液为NaCl、NaAlO2的混合液,根据钠离子守恒n(NaOH)=n(NaCl)+n(NaAlO2),再结合氯离子守恒、Al原子守恒可知n(NaOH)=c(Cl-)+n(Al3+)=0.26mol+0.06mol=0.32mol,
所以至少需要4mol/L氢氧化钠溶液的体积为$\frac{0.32mol}{4mol/L}$=0.08L=80mL,
故选C.
点评 本题考查混合物的有关计算,利用原子守恒简化解题,关键在于清楚反应后溶液为NaCl、NaAlO2的混合液.

练习册系列答案
相关题目
12.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法正确的是( )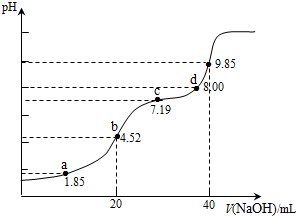

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
13.现有一组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
10.下列离子方程式中,正确的是( )
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
17.2012年2月,国务院同意发布新修订的《环境空气质量标准》增加了PM 2.5监测指标(PM 2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物).下列情况不会增加空气中PM 2.5的是( )
| A. | 直接露天焚烧秸秆 | B. | ?风能发电 | ||
| C. | 汽车直接排放尾气 | D. | 用石油作燃料 |
11.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3NA | |
| B. | 1mol苯酚中“C=C”的个数为3NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
12.下表是元素周期表的一部分,请用化学用语回答:
(1)最高价氧化物对应的水化物中酸性最强的是HClO4;
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键;其电子式为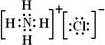 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O;
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键;其电子式为
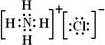 .
. 
