题目内容
1.短周期元素X、Y、Z、W、Q在元素周期表中的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法中不正确的是( )| X | Y | ||
| Z | W | Q |
| A. | 由Y与W形成的氧化物溶于水一定是强酸 | |
| B. | Z和Y组成的物质是原子晶体 | |
| C. | Z与Q形成的物质能与H2在一定条件下反应 | |
| D. | X和Y均存在同素异形体 |
分析 由短周期元素X、Y、Z、W、Q在元素周期表中的位置可知,X、Y处于第二周期,Z、W、Q处于第三周期,X元素的原子内层电子数是最外层电子数的一半,则最外层电子数为4,故X为碳元素,则Z为Si元素、Y为氧元素、W为硫元素、Q为Cl元素,据此解答.
解答 解:由短周期元素X、Y、Z、W、Q在元素周期表中的位置可知,X、Y处于第二周期,Z、W、Q处于第三周期,X元素的原子内层电子数是最外层电子数的一半,则最外层电子数为4,故X为碳元素,则Z为Si元素、Y为氧元素、W为硫元素、Q为Cl元素.
A.由Y与W形成的氧化物溶于水可以得到亚硫酸、硫酸,硫酸为强酸,但亚硫酸属于中强酸,故A错误;
B.Z和Y组成的物质是二氧化硅,属于原子晶体,故B正确;
C.Z与Q形成的物质为SiCl4,能与H2在一定条件下反应生成Si与HCl,故C正确;
D.碳元素有金刚石、石墨等同素异形体,氧元素存在氧气、臭氧同素异形体,C、O元素都能形成多种同素异形体,故D正确;
故选A.
点评 本题考查结构性质位置关系,难度中等,注意整体把握元素周期表的结构,C选项为易错点,注意利用氧化还原反应知识解答.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
12.已知:pKa=-lgKa,25℃时,H2SO3的 pKa1=1.85,pKa2=7.19.用0.1mol•L-1NaOH溶液滴定20mL0.1mol•L-1H2SO3溶液的滴定曲线如图所示(曲线上的数字为pH).下列说法正确的是( )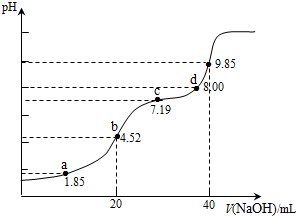

| A. | a点所得溶液中:2c(H2SO3)+c(SO32-)=0.1 mol•L-1 | |
| B. | b点所得溶液中:c(H2SO3)+c(H+)=c(SO32-)+c(OH-) | |
| C. | c点所得溶液中:c(Na+)<3c($HS{{{O}_{3}}^{-}}_{\;}$) | |
| D. | d点所得溶液中:c(Na+)>c(SO32-)>c(HSO3-) |
9.O3是重要的氧化剂和水处理剂,在平流层存在:2O3?3O2,O3?O+O2.粒子X能加速O3的分解:X+O3═XO+O2;XO+O═X+O2(X=Cl、Br、NO等).已知:2O3(g)?3O2(g)△H=-144.8kJ/mol,t℃时K=3×1076.下列说法不正确的是( )
| A. | 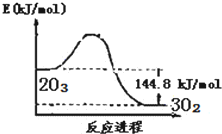 O3转变为O2能量曲线可用图表示 | |
| B. | O3转变为O2为氧化还原反应 | |
| C. | 臭氧层中氟里昂释放出的氯原子是O3分解的催化剂 | |
| D. | t℃时,3O2(g)?2O3(g),K′≈3.33×10-77 |
13.现有一组溶液:①汽油和氯化钠溶液;②39%的乙醇溶液;③氯化钠和单质碘的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液 蒸馏 萃取 | B. | 萃取 蒸馏 分液 | C. | 分液 萃取 蒸馏 | D. | 蒸馏 萃取 分液 |
10.下列离子方程式中,正确的是( )
| A. | 铁与稀硫酸反应 Fe+2H+═Fe3++H2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-═Al(OH)3↓ | |
| C. | 碳酸钙与稀盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| D. | 氢氧化铝与足量盐酸反应 Al(OH)3+3H+═Al3++3H2O |
11.设阿伏加德罗常数的值为NA,则下列说法正确的是( )
| A. | 14g乙烯和丙烯的混合物中,含有共用电子对数目为3NA | |
| B. | 1mol苯酚中“C=C”的个数为3NA | |
| C. | 标准状况下,1L戊烷充分燃烧后生成的气态产物的分子数为$\frac{5}{22.4}$NA | |
| D. | 标准状况下,560mL甲烷和甲醛的混合气体中,含有的共用电子对数为0.1NA |
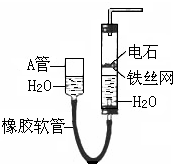 如图中的实验装置可用于制取乙炔.请填空:
如图中的实验装置可用于制取乙炔.请填空: .
.