题目内容
如图表代表周期表中的几种短周期元素,下列说法中错误的是( )
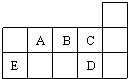

| A、A、B、C第一电离能的大小顺序为C>B>A |
| B、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:根据元素在周期表中的位置知,A、B、C、D、E分别是N、O、F、Cl、Si元素,
A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
B.元素的非金属性越强,其气态氢化物越稳定,气态氢化物属于分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的物质导致其熔沸点升高;
C.根据价层电子对互斥理论确定原子杂化类型;
D.根据元素的原子最外层电子数和化合价判断.
A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素;
B.元素的非金属性越强,其气态氢化物越稳定,气态氢化物属于分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的物质导致其熔沸点升高;
C.根据价层电子对互斥理论确定原子杂化类型;
D.根据元素的原子最外层电子数和化合价判断.
解答:
解:根据元素在周期表中的位置知,A、B、C、D、E分别是N、O、F、Cl、Si元素,
A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以A、B、C第一电离能的大小顺序为C>A>B,故A错误;
B.元素的非金属性越强,其气态氢化物越稳定,气态氢化物属于分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的物质导致其熔沸点升高,非金属性F>Cl,且HF中含有氢键、HCl中不含氢键,所以C、D气态氢化物稳定性强弱和沸点高低均为C>D,故B正确;
C.NCl3和SiCl4两分子的中心原子价层电子对个数都是4,所以均为sp3杂化,故C正确;
D.SiCl4分子中Si的化合价为+4价,Cl的化合价为-1价,Si的原子最外层电子数为4,Cl的原子最外层电子数为7,则各原子都达到了8电子稳定结构,故D正确,
故选A.
A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以A、B、C第一电离能的大小顺序为C>A>B,故A错误;
B.元素的非金属性越强,其气态氢化物越稳定,气态氢化物属于分子晶体,分子晶体的熔沸点与其相对分子质量成正比,但含有氢键的物质导致其熔沸点升高,非金属性F>Cl,且HF中含有氢键、HCl中不含氢键,所以C、D气态氢化物稳定性强弱和沸点高低均为C>D,故B正确;
C.NCl3和SiCl4两分子的中心原子价层电子对个数都是4,所以均为sp3杂化,故C正确;
D.SiCl4分子中Si的化合价为+4价,Cl的化合价为-1价,Si的原子最外层电子数为4,Cl的原子最外层电子数为7,则各原子都达到了8电子稳定结构,故D正确,
故选A.
点评:本题考查元素周期表和元素周期律的综合应用,涉及元素第一电离能、8电子结构、原子杂化方式判断等知识点,根据元素周期律、8电子结构判断方法、价层电子对互斥理论等知识点分析解答,注意分子晶体沸点高低与化学键无关,只与分子间作用力有关,为易错点.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
从矿物学资料查得,一定条件下自然界存在如下反应:14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4.下列说法正确的是( )
| A、Cu2S既是氧化产物又是还原产物 |
| B、5 mol FeS2发生反应,有14mol电子转移 |
| C、产物中的SO42-有一部分是氧化产物 |
| D、FeS2只作还原剂 |
下列事实能用同一原理解释的是:( )
| A、Na2O2和活性炭均能使品红溶液褪色 |
| B、对碘晶体和碳酸氢铵晶体加热,晶体均会逐渐消失 |
| C、实验室配制FeCl3和SnCl2溶液时,先将固体FeCl3和SnCl2分别溶解在浓盐酸中,再加蒸馏水稀释 |
| D、SO2能使滴加酚酞的NaOH溶液和酸性KMnO4溶液的红色都褪去 |
常温时,将a1 mL、b1 mol?L-1的CH3COOH溶液加入到a2 mL、b2 mol?L-1的NaOH溶液中,下列结论中正确的是( )
| A、如果a1b1=a2b2,则混合溶液的pH=7 |
| B、如果混合液的pH=7,则混合溶液中c(CH3COO-)=c(Na+) |
| C、如果a1=a2,b1=b2,则混合溶液中c(CH3COO-)=c(Na+) |
| D、如果a1=a2,且混合溶液的pH>7,则b1<b2 |
下列实验操作中,正确的是( )
| A、为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动 |
| B、为了使烧杯中的液体更快地升温,不垫石棉网而直接置于外焰上加热 |
| C、为加速固体物质的溶解可采用粉碎、振荡、搅拌、加热等方法 |
| D、萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
“神舟六号”飞船用铝粉与NH4ClO4的混合物为固体燃料进行太空姿态调整,点燃时铝粉氧化放热引发下面反应:2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g);△H<O,下列叙述错误的是( )
| A、NH4ClO4的分解反应瞬间产生大量高温气体推动航天飞船飞行 |
| B、Cl2是氧化产物,N2和O2是还原产物 |
| C、从能量变化上说反应主要是化学能转变为热能和动能 |
| D、每分解1mol NH4ClO4,转移7mole- |
 实验室中制取少量干燥纯净的气体A,可用如图装置
实验室中制取少量干燥纯净的气体A,可用如图装置