题目内容
“神舟六号”飞船用铝粉与NH4ClO4的混合物为固体燃料进行太空姿态调整,点燃时铝粉氧化放热引发下面反应:2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g);△H<O,下列叙述错误的是( )
| A、NH4ClO4的分解反应瞬间产生大量高温气体推动航天飞船飞行 |
| B、Cl2是氧化产物,N2和O2是还原产物 |
| C、从能量变化上说反应主要是化学能转变为热能和动能 |
| D、每分解1mol NH4ClO4,转移7mole- |
考点:氧化还原反应
专题:氧化还原反应专题
分析:反应2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g) △H<O中,反应物高氯酸铵为化合物,产物中N2为单质,有元素化合价的变化,故该反应为氧化还原反应,为放热反应,结合氧化还原反应的知识分析解答.
解答:
解:A.2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g);△H<O,△H<O表示放热,同时生成大量气体,大量高温气体推动航天飞船飞行,故A正确.
B.2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g)中Cl元素的化合价降低,则Cl2为还原产物,N元素和O元素的化合价升高,则N2和O2是氧化产物,故B错误;
C、航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,燃料反应为放热反应,反应从能量变化上说,主要是化学能转变为热能和动能,故C正确;
D.2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g) ,2molNH4ClO4参加反应,2mol+7价Cl变成0价的1mol Cl2转移14 mol电子,则每分解1mol NH4ClO4,转移7mole-,故D正确;
故选B.
B.2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g)中Cl元素的化合价降低,则Cl2为还原产物,N元素和O元素的化合价升高,则N2和O2是氧化产物,故B错误;
C、航天飞机用的铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,燃料反应为放热反应,反应从能量变化上说,主要是化学能转变为热能和动能,故C正确;
D.2NH4ClO4(s)═N2(g)+4H2O(l)+Cl2(g)+2O2(g) ,2molNH4ClO4参加反应,2mol+7价Cl变成0价的1mol Cl2转移14 mol电子,则每分解1mol NH4ClO4,转移7mole-,故D正确;
故选B.
点评:本题以信息的形式考查氧化还原反应及能量,掌握分解反应的特点,理解氧化还原反应的本质,注意放热反应、吸热反应的标志以及氧化还原反应的知识是解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图表代表周期表中的几种短周期元素,下列说法中错误的是( )
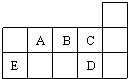

| A、A、B、C第一电离能的大小顺序为C>B>A |
| B、C、D气态氢化物稳定性强弱和沸点高低均为C>D |
| C、AD3和ED4两分子的中心原子均为sp3杂化 |
| D、ED4分子中各原子均达8电子结构 |
实验室配制250mL 0.2mol?L-1的Na2CO3溶液,必需用到的仪器是( )
A、 锥形瓶 |
B、 试管 |
C、 酒精灯 |
D、 容量瓶 |
热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ?mol-1表示…( )
| A、碳和水反应吸收131.3 kJ能量 |
| B、1个固态碳原子和1分子水蒸气反应吸热131.3 kJ |
| C、1 mol碳和1 mol水反应生成1 mol一氧化碳和1 mol氢气并吸收131.3 kJ热量 |
| D、1 mol固态碳和1 mol水蒸气反应生成1 mol一氧化碳气体和1 mol氢气并吸收131.3 kJ热量 |
下列说法中正确的是( )
| A、油脂、淀粉、蛋白质均为可水解的高分子化合物. | ||||
B、日本福岛核电站爆炸时释放的两种放射性核素
| ||||
| C、硅酸凝胶、氯化钠注射液属于胶体. | ||||
| D、为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术 |
下列各组物质中,互为同分异构体的是( )
|
|
A、CH3CH2CH2CH3与 | ||||
| B、NO与NO2 | ||||
| C、O2与O3 | ||||
D、
|
从1L1mol/L的NaOH溶液中,取出50mL溶液,该50mL NaOH溶液的物质的量浓度为( )
| A、0.02mol/L |
| B、0.2mol/L |
| C、1 mol/L |
| D、2mol/L |
 ,写出由C制备化合物
,写出由C制备化合物 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:CH3CH2OH